

分析 (1)盐酸与碳酸钙反应生成二氧化碳气体和氯化钙,其中盐酸易挥发,据此选择仪器;
(2)①饱和澄清石灰水与碳酸钠和碳酸氢钠均能反应生成碳酸钙沉淀,据此解答;
②计算此时溶液中钡离子浓度与碳酸根浓度的乘积与该温度下碳酸钡的溶度积常数比较即可;
③取用实验室中分析纯与样品进行pH的测算比较即可;
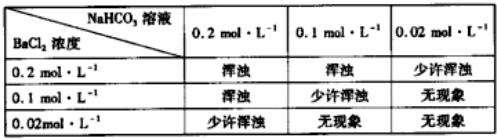
④发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,由图中所给数据可知剩余固体为6.3g,计算固体质量减少量,依据图象可知温度升高对剩余固体的质量无影响.
解答 解:(1)③为发生装置,盐酸与碳酸钙反应生成二氧化碳气体和氯化钙,其中盐酸易挥发,故应先选取碳酸氢钠除去混合气体中的HCl,故仪器连接顺序为:③①②,故答案为:③①②;
(2)①饱和澄清石灰水与碳酸钠和碳酸氢钠均能反应生成碳酸钙沉淀,故甲方案不可行,故答案为:不可行;
②(i)两种溶液等体积混合后,溶液中钡离子浓度=$\frac{0.2mol/L}{2}$=0.1mol/L,0.1 mol•L-1 NaHC03溶液电离出的c(CO32-)为0.0011 mol•L-1,故Q=Q=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9,故会产生沉淀,故答案为:Q=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9;
(ii)钡离子与碳酸氢钠电离出的碳酸根结合生成碳酸钡沉淀,从而促进了碳酸氢根的电离,使其向生成碳酸根和氢离子的方向移动,故离子反应方程式为:Ba2++2HCO3-=BaCO3↓+CO2↑+H2O,故答案为:Ba2++2HCO3-=BaCO3↓+CO2↑+H2O;
③丙方案为测定pH法,由于碳酸氢钠属于强碱弱酸盐,故利用准确度较高的pH计进行样品的pH值,然后测量分析纯NaHC03的pH值,最后比较即可,故答案为:取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH;
④(i)碳酸氢钠不稳定,加热易分解,方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,即
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
168 106
10g x,解x=6.30g,
即理论上碳酸氢钠每有10g分解应生成6.3g固体,故由图可知10g样品分解恰好生成固体为6.3g,故此样品纯度为:$\frac{6.3g}{6.3g}$×100%=100%,故答案为:100%;
(ii)由图可知,温度升高,不影响固体物质的产量,升温速率对实验结果没有影响,故答案为:没有.
点评 本题综合考查的是物质的制备方案的设计,混合物的测定,涉及知识点较多,难度较大,熟练掌握碳酸氢钠的性质以及其热分解原理是解决本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl的水溶液中置换出金属钠 | |
| C. | Li、Na、K、Rb、Cs等碱金属单质都是银白色 | |
| D. | 碱性:LiOH>NaOH>KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 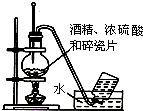 实验室用乙醇制取乙烯 | B. |  实验室制取乙酸乙酯 | ||
| C. | 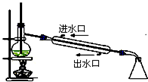 石油分馏 | D. |  实验室制取硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子总数为0.2 NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 乙二醇与钠的在反应中,每生成1molH2消耗乙二醇1mol | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯硝化生成三硝基甲苯 | B. | 甲苯能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲苯燃烧带有浓厚的黑烟 | D. | 甲苯与氢气可以生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②⑥ | B. | 只有③⑥ | C. | 只有③④ | D. | 只有⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
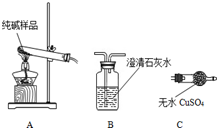 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com