
| 7.2g |
| 18g/mol |


科目:高中化学 来源: 题型:
| A、用H2O2分解制氧气,消耗1mol H2O2,转移电子为2mol |
| B、0.5molH2和0.5molO2的混合气体为22.4L |
| C、16gO2和O3的混合气体中含有O数目为NA |
| D、在反应MnO2+4HCl═MnCl2+Cl2↑+2H2O中,每生成1molCl2有2molHCl被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚钠溶液中通入少量CO2 2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 | ||
B、乙酸乙酯在酸性条件下水解 CH3COOCH2CH3+H218O
| ||
C、溴乙烷的消去反应 C2H5Br+NaOH
| ||
D、乙醛和银氨溶液反应 CH3CHO+2Ag(NH3)2OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硅酸钠溶液中滴入稀盐酸,溶液变浑浊,说明Cl元素的非金属性强于Si元素 |
| B、Zn与稀硫酸反应时,滴加少量CuSO4溶液,反应速率加快,说明CuSO4在该反应中起催化剂作用 |
| C、用酚酞作指示剂,盐酸滴定Na2CO3溶液,达到滴定终点时,离子浓度关系为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D、将NaAlO2溶液与NaHCO3溶液混合,出现白色沉淀,是两种溶液水解相互促进的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
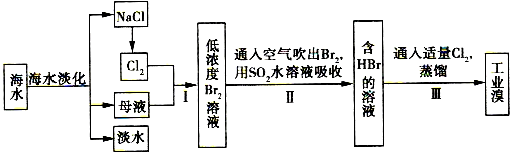
查看答案和解析>>
科目:高中化学 来源: 题型:
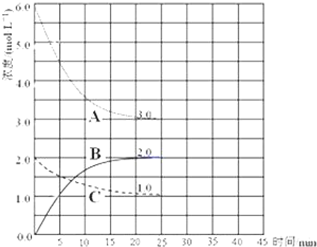 目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;
目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;查看答案和解析>>
科目:高中化学 来源: 题型:
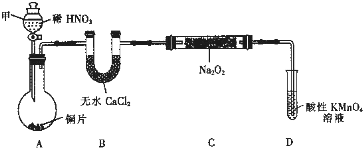
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg?L-1 | 0 | 20 | 40 | 60 | 80 |
| 粉碎浸泡 |
| 过滤 |
| 明矾 |
| 静置过滤 |
| 稀释至1L |
| 实验方案 | 实验现象 | 实验结论 |
| 维生素C可以降低泡菜中NaNO2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com