
| 选项 | 实验操作 | 实现现象 | 结论 |
| A | 向浓度均为0.1mol/L NaCl、KI混合液中逐滴加入AgNO3溶液 | 先出现黄色沉淀 | 溶解性:AgCl>AgI |
| B | 溴乙烷与NaOH的乙醇溶液共热,将逸出气体通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 证明有乙烯生成 |
| C | 向X的溶液中滴入浓NaOH溶液,将干燥红色石蕊试纸置于管口 | 无明显现象 | X溶液中无NH4+ |
| D | 将SO2气体通入Ba(NO3)2溶液 | 产生白色沉淀 | 沉淀为BaSO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶解度小的物质先生成沉淀;
B.乙醇和乙烯都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
C.NH4+和浓NaOH溶液反应生成NH3,NH3和水反应生成的NH3.H2O电离出OH-而使红色石蕊试纸变蓝色;
D.二氧化硫具有还原性,能被Ba(NO3)2溶溶液氧化生成BaSO4沉淀.
解答 解:A.沉淀可以转化为溶解度更小的沉淀,向浓度为0.1mol/LNaCl、KI混合液中逐滴加入AgNO3溶液,现出现黄色沉淀,说明溶解性:AgCl>AgI,故A正确;
B.乙醇易挥发,能被酸性高锰酸钾溶液氧化而使高锰酸钾褪色,所以不能排除乙醇的干扰,应该先用水吸收乙醇再将得到的气体通入酸性高锰酸钾溶液中,故B错误;
C.氨根离子检验应向溶液中加入氢氧化钠,然后将湿润的红色石蕊试纸置于管口,若变蓝证明存在氨根离子,氨气不能使干燥的红色石蕊试纸变蓝色,故C错误;
D.将SO2气体通入Ba(NO3)2溶液,发生氧化还原反应生成BaSO4沉淀,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断能力,涉及氧化还原反应、离子检验、物质检验等知识点,明确实验原理及物质性质是解本题关键,检验物质时要排除其它物质的干扰,易错选项是BD.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的醋酸的导电能力比纯醋酸的导电能力弱 | |
| B. | PH均为5的盐酸和NH4Cl溶液中水电离出来的c(H+)均为1×10-5mol•L-1 | |
| C. | PH=8.3的NaHC03溶液中:c(Na+)>c(HCO3- )>c(CO32-)>c(H2CO3) | |
| D. | 向0.10mol•L-1 NaHSO3溶液中通入NH3至溶液的PH=7,此时溶液中:c(Na+)>c(SO32-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g 2H2O所含中子总数为NA | |
| B. | 1 L 1 mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 12g石墨和C60的混合物中质子总数为6NA | |
| D. | 反应KIO3+6HI═KI+3H2O+3I2中,生成1mol I2转移电子的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温下分别在100g水中最多能溶解的无水CuSO4和CuSO5•5H2O的质量 | |
| B. | 纯水在25℃和90℃时的pH值 | |
| C. | 25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 | |
| D. | 在反应NH3+NO→N2+H2O中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
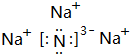 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$、K+ | B. | K+、Cl-、Na+、SO${\;}_{4}^{2-}$ | ||
| C. | Mg2+、NO${\;}_{3}^{-}$、K+、Cl- | D. | Na+、Ba2+、Ca2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com