
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为 mol。
②d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如图-2。

①冶炼过程中,正极周围溶液的pH (填“增大”、“减小”或“不变”)。
②负极产生单质硫的电极反应式为 。
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如图-3。
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s) + H2(g) | ΔH1 | K1 |
| 1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
| FeS(s) + H2(g) | ΔH3 | K3 |

①上述反应中,ΔH1 0(填“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
【答案】(1)①14;②FeS2 +14Fe3++8H2O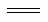 15Fe2++2
15Fe2++2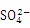 +16H+
+16H+
(2)①增大;②CuFeS2-4e-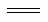 Cu2++Fe2++2S
Cu2++Fe2++2S
(3)①>;②升高温度(或提高氢气的浓度或及时除去生成的H2S);③2lgK2=lgK1+lgK3
【解析】本题考查了氧化还原反应、电化学和化学平衡的相关知识。(1)①a反应中铁化合价没有变化,S元素从-1价升高到+6价,1mol FeS2生成1molFeSO4转移电子的物质的量为2×7=14;②Fe3+与 发生氧化还原反应,方程式:FeS2 +14Fe3++8H2O
发生氧化还原反应,方程式:FeS2 +14Fe3++8H2O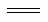 15Fe2++2
15Fe2++2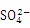 +16H+;(2)①根据电子移动方向可知,CuFeS2是负极,FeS2是正极,冶炼过程中,H+在正极跟O2反应生成了水,使得H+降低,导致正极周围溶液的pH增大;②负极CuFeS2发生氧化反应生成Cu2+、Fe2+和S;(3)①根据图象,随着温度升高,lgK1逐渐增大,即K1逐渐增大,平衡向右移动,因此正反应为吸热反应;②反应1与反应3相加得到反应2×2,即FeS2(s) + 2H2(g)
+16H+;(2)①根据电子移动方向可知,CuFeS2是负极,FeS2是正极,冶炼过程中,H+在正极跟O2反应生成了水,使得H+降低,导致正极周围溶液的pH增大;②负极CuFeS2发生氧化反应生成Cu2+、Fe2+和S;(3)①根据图象,随着温度升高,lgK1逐渐增大,即K1逐渐增大,平衡向右移动,因此正反应为吸热反应;②反应1与反应3相加得到反应2×2,即FeS2(s) + 2H2(g) Fe(s)+2H2S(g),提高H2的浓度,可以提高硫的脱除率,根据①的方向可知,升高温度可以提高硫的脱除率;根据平衡移动的因素,及时除去H2S,也可以提高硫的脱除率;③根据②的分析,K22= K1×K3,因此2lgK2=lgK1+lgK3。
Fe(s)+2H2S(g),提高H2的浓度,可以提高硫的脱除率,根据①的方向可知,升高温度可以提高硫的脱除率;根据平衡移动的因素,及时除去H2S,也可以提高硫的脱除率;③根据②的分析,K22= K1×K3,因此2lgK2=lgK1+lgK3。


科目:高中化学 来源: 题型:
下列表示水解的离子方程式正确的是( )
|
| A. | CH3COO﹣+H2O⇌CH3COOH+OH﹣ | B. | NH4++H2O⇌NH4OH+H+ |
|
| C. | S2﹣+2H2O⇌H2S+2OH﹣ | D. | HCO3﹣+H2O⇌H3O++CO32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对难溶电解质的溶解平衡的叙述,错误的是
A.难溶电解质的溶解平衡是一种动态平衡
B.达到溶解平衡时,沉淀的速率和溶解的速率相等,溶液中离子的浓度保持不变
C.达到溶解平衡时,溶液中各种离子的浓度不一定相等
D.达到溶解平衡时,再加入该难溶电解质,将促进其溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是
A.食醋呈酸性的原因是:CH3COOH+H2O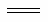 CH3COO-+H3O+
CH3COO-+H3O+
B.纯碱溶液呈碱性的原因是: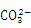 +2H2O
+2H2O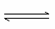 H2CO3+2OH-
H2CO3+2OH-
C.用铁作阳极,电解饱和食盐水的离子方程式:Fe+2H2O Fe(OH)2+H2↑
Fe(OH)2+H2↑
D.表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)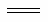 2H2O(l);
2H2O(l); H=-571.6kJ·mol-1
H=-571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
| A.V=44.8 | B.原样品中Fe元素的质量分数为38.89% |
| C.滤液A中的阳离子为Fe2+、Fe3+、H+ | D.样品中CuO的质量为4.0 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.2mol•L﹣1 HCN溶液和0.1mol•L﹣1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
( )
|
| A. | c(HCN)<c(CN﹣) | B. | c(Na+)<(CN﹣) |
|
| C. | c(HCN)﹣c(CN﹣)=c(OH﹣) | D. | c(HCN)+c(CN﹣)=0.1mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.下列有关说法正确的是( )
|
| A. | 四种溶液的KW相同,由水电离的c(H+):①=③>②=④ |
|
| B. | 向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
|
| C. | ②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
|
| D. | 将②、③两种溶液混合后,若pH=7,消耗溶液的体积为:③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
|
| A. | 该溶液的pH=4 |
|
| B. | 升高温度,溶液的pH增大 |
|
| C. | 此酸的电离平衡常数约为1×10﹣7 |
|
| D. | 由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B两种有机物组成的混合物.当其质量一定时,无论A、B以何种比例混合,完全燃烧产生水的质量均相等.一定符合条件的是( )
①正丁烷与异丁烷 ②乙烯与丙烯 ③乙炔和苯 ④甲烷与丙炔.
|
| A. | 全部 | B. | 只有① | C. | 只有①② | D. | 只有①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com