
| A. | H2S的电子式: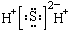 | B. | S2-的结构示意图: | ||
| C. | Na2O2的电子式: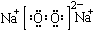 | D. | CCl4的电子式: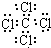 |
分析 A.C.D.先判断化合物类型及所含化学键类型,离子化合物由阳离子与银离子构成,阳离子电子式为阳离子符合,阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构,据此解答.
B.硫离子的核电荷数=核外电子总数+2=18,最外层为8个电子;
解答 解:A.H2S为共价化合物,以共用电子对形成化合物,其电子式为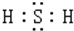 ,故A错误;
,故A错误;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为: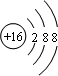 ,故B错误;
,故B错误;
C.过氧化钠为离子化合物,2个钠离子与过氧根离子通过离子键结合,两个氧原子之间共用1对电子,电子式: ,故C错误;
,故C错误;
D.四氯化碳为共价化合物,碳原子与四个氯原子分别共用1对电子,电子式:,故D正确;
故选D.
点评 本题考查了电子式的书写,明确物质所含化学键的类型及电子式书写应注意的问题是解题关键,注意金属阳离子电子式为其离子符号.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
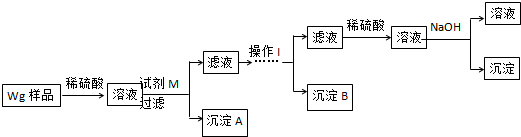
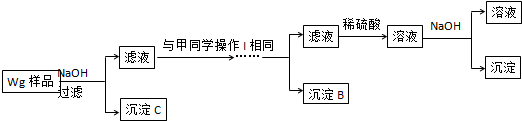
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (2)乙炔的结构式H-C≡C-H
(2)乙炔的结构式H-C≡C-H查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com