
【题目】探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)工业上利用Na2CO3溶液吸收NO、NO2混合气制备NaNO2,该反应可实现NO和NO2的完全转化,反应的化学方程式为________。
(2)NO2可发生二聚反应生成N2O4,化学方程式为![]() ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的![]() ________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数;
________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数; ![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随![]() 变化关系的是斜线________。
变化关系的是斜线________。
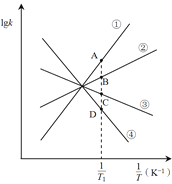
(3)图中A、B、C、D点的纵坐标分别为a + 1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K=_______mol-1·L。已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2 mol·L-1,此时υ正________υ逆(填>或<);上述反应达到平衡后,继续通入一定量的NO2,则NO2的平衡转化率将________,NO2的平衡浓度将________(填增大、减小或不变)。
【答案】NO + NO2 + Na2CO3=2NaNO2 + CO2 < ③ ④ 10 > 增大 增大
【解析】
(1)Na2CO3溶液和NO、NO2反应生成NaNO2,再写出化学方程式;
(2)升高温度体系颜色加深,平衡逆移,则正反应为放热反应;化学反应速率和温度成正比,随着温度下降 ![]() 增大,正逆反应速率下降,则lgk正和lgk逆均减小,由于温度下降平衡正移,υ正>υ逆,则下降相同温度时lgk逆减小更快,以此分析;
增大,正逆反应速率下降,则lgk正和lgk逆均减小,由于温度下降平衡正移,υ正>υ逆,则下降相同温度时lgk逆减小更快,以此分析;
(3)化学平衡常数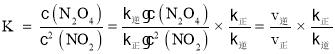 ,平衡时υ正=υ逆再利用C点和D点数据求得k逆和k正;比较浓度商Q与K值得大小,若Q>K则平衡逆移,若Q<K则平衡正移,若Q=K则达到平衡;上述反应达到平衡后,继续通入一定量的NO2,等效于达到平衡后加压,平衡正移;根据勒夏特列原理,达到平衡时浓度比起始时大。
,平衡时υ正=υ逆再利用C点和D点数据求得k逆和k正;比较浓度商Q与K值得大小,若Q>K则平衡逆移,若Q<K则平衡正移,若Q=K则达到平衡;上述反应达到平衡后,继续通入一定量的NO2,等效于达到平衡后加压,平衡正移;根据勒夏特列原理,达到平衡时浓度比起始时大。
(1)Na2CO3溶液和NO、NO2反应生成NaNO2,根据元素守恒化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)升高温度体系颜色加深,平衡逆移,则正反应为放热反应![]() <0;化学反应速率和温度成正比,随着温度下降
<0;化学反应速率和温度成正比,随着温度下降 ![]() 增大,正逆反应速率下降,则lgk正和lgk逆均减小,由于温度下降平衡正移,υ正>υ逆,则下降相同温度时lgk逆减小更快,则③表示lgk正随
增大,正逆反应速率下降,则lgk正和lgk逆均减小,由于温度下降平衡正移,υ正>υ逆,则下降相同温度时lgk逆减小更快,则③表示lgk正随![]() 变化关系的是斜线,④表示lgk逆随
变化关系的是斜线,④表示lgk逆随![]() 变化关系的是斜线,故答案为:<;③;④;
变化关系的是斜线,故答案为:<;③;④;
(3)化学平衡常数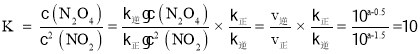 ;NO2、N2O4浓度均为0.2 mol·L-1,则浓度商
;NO2、N2O4浓度均为0.2 mol·L-1,则浓度商![]() <K,则平衡正移,υ正>υ逆;上述反应达到平衡后,继续通入一定量的NO2,等效于达到平衡后加压,平衡正移;根据勒夏特列原理,达到平衡时浓度比起始时大,故答案为:10;>;增大;增大。
<K,则平衡正移,υ正>υ逆;上述反应达到平衡后,继续通入一定量的NO2,等效于达到平衡后加压,平衡正移;根据勒夏特列原理,达到平衡时浓度比起始时大,故答案为:10;>;增大;增大。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。
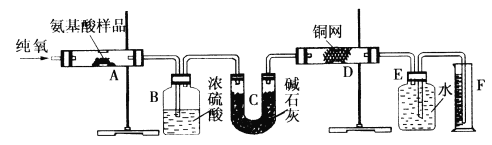
回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏伽德罗常数的值。下列说法不正确的是( )
A. 12g金刚石中平均含有2NA个σ键
B. 1mol SiO2晶体中平均含有4NA个σ键
C. 12g石墨中平均含1.5NA个σ键
D. 1mol CH4中含4NA个s﹣p σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
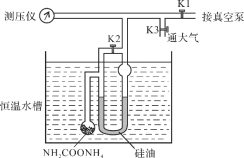
【题目】氨基甲酸铵发生分解的化学方程式为NH2COONH4(s)![]() 2NH3(g) + CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g) + CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1;
(Ⅱ)关闭K2,缓慢开启K3至U型管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0 kPa、17.1 kPa。下列说法错误的是
A.氨基甲酸铵分解反应的ΔH>0
B.该反应25℃时的化学平衡常数Kp = 2.56×1011 Pa3
C.步骤Ⅰ中测压仪数值未稳定即关闭K1,Kp测量值偏小
D.步骤Ⅱ中读数时U型管左侧液面偏高,Kp测量值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下①9.6gCH4 ②1molHCl分子 ③17.92 L H2S ④2.408×1023个NH3分子。则
A. 体积:②>③>④>① B. 密度:②>③>①>④
C. 质量:②>③>④>① D. H原子个数:①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所给出的装置图回答下列问题:
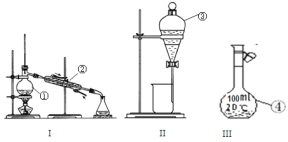
(1)①~④中,使用前必须检查是否漏水的是____________(填仪器序号)。
(2)分离溴水中的溴应先选择装置_____(填Ⅰ、Ⅱ、Ⅲ或Ⅳ序号,下同),进行操作A_______(填操作名称,下同);再选装置_____,进行操作B________;操作A需在溴水中加一种试剂,选择这一试剂时,下列性质你认为哪些是必需的:_______(填字母)。
A. 常温下为液态 B. Br2在其中溶解程度小 C. 与水互不相溶
D. 密度比水大 E. 与Br2不反应 F. 溶解Br2后呈现橙红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是

A. 1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量
C. 通常情况下,N2(g)和O2(g)混合能直接生成NO(g)
D. 吸热反应一定需要加热才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42- 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)判断BaCl2已过量的方法是_______________________________________________。
(2)第④步中,相关的离子方程式是___________________________________________。
(3)若先用盐酸再过滤,将对实验结果产生影响,其原因是______________________________。
(4)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,其中的错误是____________________________________________。
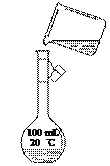
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com