
【题目】在四种化合物①NaHCO3、②Al(OH)3、③(NH4)2S、④NH2-CH2COOH中盐酸和氢氧化钠溶液都能反应的是
A. ①②③④ B. 只有①② C. 只有②④ D. 只有①②③
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】I. A、 B、 C、 D、 E 均为中学化学常见的纯净物, B 为最常见液体,它们之间有如下的反应关系:
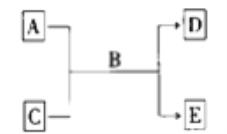
(1)若 A 为短周期的金属单质, D 为气态单质, 0.1 mol· L-1 C 溶液的 pH=13,则该反应的离子方程式为_______________________________________。
(2)若 A 的溶液能使淀粉溶液变蓝, C 为非金属氧化物, 且能使品红溶液褪色, 则该反应的化学方程式为_______________________________________。
(3)若 A、 C、 D、 E 均为化合物, E 为白色胶状沉淀,且 A、 C、 E 均含有同一种元素, 则该反应的离子方程式为_____________________________________。
(4)若单质 A 是良好的半导体材料,请写出工业上制取单质 A 粗品的化学方程式为________________________。
II.(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由 KClO3 在 H2SO4存在下与Na2SO3 反应制得。请写出该反应的离子方程式___________________________________________________________________。
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为 Na2CO3·3H2O2,它具有 Na2CO3和 H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是______ (填字母)。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)![]() xC(?)+3D(?)。反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如下图所示。下列有关说法正确的是
xC(?)+3D(?)。反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如下图所示。下列有关说法正确的是
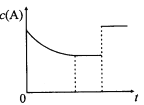
A.x=2,C为气态,D可能为气态也可能为非气态
B.改变的条件可能是使用了催化剂
C.其他条件不变,若向容器中加入少量C,A的平衡转化率不变
D.该反应的化学平衡常数K=[c(C)]2/c(A) ·c(B),且温度升高,K值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于放热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④B.⑤C.①④⑤D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
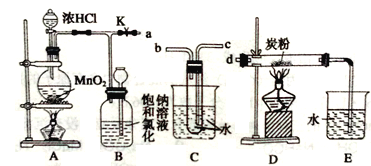
(1)A中盛放浓盐酸的仪器的名称是______________。
(2)要将C装置接入B和D之间,正确的接法是a→_____→_____→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是__________________。
(4)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___________。
II、某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)漂白粉将在U型管中产生,其化学反应方程式是___________。
(2)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:

①温度较高时氯气与消石灰反应生成了Ca(C1O3)2,为避免此副反应的发生,可采取的措施是___________________。
②试判断另一个副反应是(写出此反应方程式)____________,为避免此副反应发生,可采取的措施是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)N2H62+在碱性溶液中反应的离子方程式:_____________________________________。
(2)NH2-的电子式为__________________________,NH2-的构型为____________。
(3)写出一种与N3-是等电子体的微粒化学式___________。
(4)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N![]() N键。则“N5”分子碎片所带电荷是_______。
N键。则“N5”分子碎片所带电荷是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是

A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是____(填符号),配合物离子[Cu(NH3)4]2+为平面正方形结构, 画出其中的配位键_____________。
(2)配合物Co[(N3)(NH3)5]SO4中Co3+的配位数为___,Co3+与NH3之间的作用属于_____(选填“离子键”、“配位键”、“范德华力”、“氢键”)。
(3)Co(Ⅲ)的八面体配合物CoClm·nNH3,若1 mol配合物与AgNO3作用生成1 molAgCl沉淀,则m=__________, n= ___________。(填具体数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
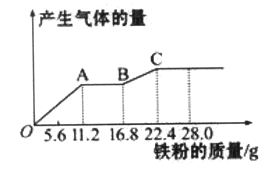
A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中NO3-物质的量为0.4 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol L-l
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com