
| Ėį | “×Ėį | “ĪĀČĖį | Ģ¼Ėį | ŃĒĮņĖį |
| µēĄėĘ½ŗā³£Źż | Ka=1.75”Į10-5 | Ka=4.2”Į10-8 | Ka1=4.30”Į10-7 Ka2=5.61”Į10-11 | Ka1=1.54”Į10-2 Ka2=1.02”Į10-7 |
| A£® | µČĪļÖŹµÄĮæÅØ¶ČµÄĖÄÖÖĖįČÜŅŗÖŠ£¬pH×ī“óµÄŹĒŃĒĮņĖį | |
| B£® | µČĪļÖŹµÄĮæÅØ¶ČµÄCH3COONa”¢NaClO”¢Na2CO3ŗĶNa2SO3 ĖÄÖÖČÜŅŗÖŠ£¬¼īŠŌ×īĒæµÄŹĒNa2CO3 | |
| C£® | ÉŁĮæCO2ĶØČėNaClOČÜŅŗÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCO2+H2O+2ClO-ØT$CO_3^{2-}$+2HClO | |
| D£® | “×ĖįÓėNaHSO3ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCH3COOH+HSO3-ØTSO2+H2O+CH3COO- |
·ÖĪö µēĄė³£ŹżŌ½“óĖįŠŌŌ½Ē棬øł¾Ż±ķÖŠµēĄėĘ½ŗā³£ŹżæÉÖŖ£¬ĖįŠŌĒæČõ£ŗŃĒĮņĖį£¾“×Ėį£¾Ģ¼Ėį£¾ŃĒĮņĖįĒāøłĄė×Ó£¾“ĪĀČĖį£¾Ģ¼ĖįĒāøłĄė×Ó£¬
A£®ĖįŌ½Čõ£¬ČÜŅŗÖŠĒāĄė×ÓÅضČŌ½Š”£¬pHŌ½“ó£»
B£®ČõĖįµÄÄĘŃĪČÜŅŗÖŠ£¬ĖįŌ½Čõ£¬ĘäĖ®½ā³Ģ¶ČŌ½“ó£¬ŌņÄĘŃĪČÜŅŗµÄ¼īŠŌŌ½Ē棻
C£®“ĪĀČĖįµÄĖįŠŌ“óÓŚĢ¼ĖįĒāøłĄė×Ó£¬ĖłŅŌ·“Ӧɜ³É“ĪĀČĖįŗĶĢ¼ĖįĒāøłĄė×Ó£»
D£®ĖįŠŌ£ŗŃĒĮņĖį£¾“×Ėį£®
½ā“š ½ā£ŗA£®ĖįŌ½Čõ£¬ČÜŅŗÖŠĒāĄė×ÓÅضČŌ½Š”£¬pHŌ½“ó£¬ŃĒĮņĖįµÄĖįŠŌ×īĒ棬ĘäpH×īŠ”£¬¹ŹA“ķĪó£»
B£®ĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄŗ¬ÓŠČõĖįøłĄė×ÓµÄÄĘŃĪČÜŅŗ£¬¶ŌÓ¦ĖįµÄĖįŠŌŌ½ČõŌņĖįøłĄė×ÓĖ®½ā³Ģ¶ČŌ½“ó£¬ČÜŅŗÖŠĒāŃõøłĄė×ÓÅضČŌ½“ó£¬pHŌ½“ó£¬Ė®½ā³Ģ¶Č“óŠ”Ė³ŠņŹĒ£ŗCH3COO-£¼SO32-£¼ClO-£¼CO32-£¬ĖłŅŌµČĪļÖŹµÄĮæÅØ¶ČµÄCH3COONa”¢NaClO”¢Na2CO3ŗĶNa2SO3 ĖÄÖÖČÜŅŗÖŠ£¬¼īŠŌ×īĒæµÄŹĒNa2CO3£¬¹ŹBÕżČ·£»
C£®“ĪĀČĖįµÄĖįŠŌ“óÓŚĢ¼ĖįĒāøłĄė×Ó£¬ĖłŅŌ·“Ӧɜ³É“ĪĀČĖįŗĶĢ¼ĖįĒāøłĄė×Ó£¬ŌņÉŁĮ涞Ńõ»ÆĢ¼ĶØČėNaClOČÜŅŗÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCO2+H2O+ClO-=HCO3-+HClO£¬¹ŹC“ķĪó£»
D£®ĖįŠŌ£ŗŃĒĮņĖį£¾“×Ėį£¬Ōņ“×ĖįÓėNaHSO3ČÜŅŗ²»·“Ó¦£¬¹ŹD“ķĪó£®
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²éČõµē½āÖŹµÄµēĄė”¢ŃĪĄąµÄĖ®½ā”¢Ńõ»Æ»¹Ō·“Ó¦µČÖŖŹ¶µć£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāÕĘĪÕČõµē½āÖŹµÄµēĄėĘ½ŗā¼°ĘäÓ°ĻģŅņĖŲ£¬Äܹ»ÕżČ·ŹéŠ“Ąė×Ó·½³ĢŹ½£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £»Al
£»Al £»O
£»O £»C
£»C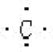 £»Cl-
£»Cl- £»
£» £»NaOH
£»NaOH £»KBr
£»KBr £»Na2S
£»Na2S £»HI
£»HI £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ŹŅĪĀĻĀ£¬ÅØ¶Č¾łĪŖ0.10mol/L£¬Ģå»ż¾łĪŖV0µÄMOHŗĶROHČÜŅŗ£¬·Ö±š¼ÓĖ®Ļ”ŹĶÖĮĢå»żV£¬pHĖęlg$\frac{V}{{V}_{0}}$µÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
ŹŅĪĀĻĀ£¬ÅØ¶Č¾łĪŖ0.10mol/L£¬Ģå»ż¾łĪŖV0µÄMOHŗĶROHČÜŅŗ£¬·Ö±š¼ÓĖ®Ļ”ŹĶÖĮĢå»żV£¬pHĖęlg$\frac{V}{{V}_{0}}$µÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | Ļ”ŹĶĒ°Į½ČÜŅŗµÄKa£ŗMOHČÜŅŗ£¾ROHČÜŅŗ | |
| B£® | ROHµÄµēĄė³Ģ¶Č£ŗbµćŠ”ÓŚaµć | |
| C£® | Į½ČÜŅŗŌŚĻ”ŹĶ¹ż³ĢÖŠ£¬c£ØH+£©¾łÖš½„¼õÉŁ | |
| D£® | µ±lg$\frac{V}{{V}_{0}}$=2Ź±£¬ČōĮ½ČÜŅŗĶ¬Ź±ÉżøßĪĀ¶Č£¬Ōņ$\frac{c£Ø{R}^{+}£©}{c£Ø{M}^{+}£©}$Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČČĀČĖį¼Ų | B£® | ¼ÓČČĀČĖį¼ŲŗĶ¶žŃõ»ÆĆĢ | ||
| C£® | ¼ÓČČøßĆĢĖį¼Ų | D£® | ¼ÓČČĖ«ŃõĖ® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | C£® |  | D£® |  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 16 | B£® | 32 | C£® | 64g/mol | D£® | 32g/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼īŠŌŃõ»ÆĪļŅ»¶ØŹĒ½šŹōŃõ»ÆĪļ£¬½šŹōŃõ»ÆĪļŅ»¶ØŹĒ¼īŠŌŃõ»ÆĪļ | |
| B£® | ÓÉĶ¬ÖÖŌŖĖŲ×é³ÉµÄĪļÖŹŹĒµ„ÖŹ£¬ÓɶąÖÖŌŖĖŲ×é³ÉµÄĪļÖŹŹĒ»ģŗĻĪļ | |
| C£® | ĖįŠŌŃõ»ÆĪļŅ»¶ØŹĒ·Ē½šŹōŃõ»ÆĪļ£¬·Ē½šŹōŃõ»ÆĪļŅ»¶ØŹĒĖįŠŌŃõ»ÆĪļ | |
| D£® | ČÜŅŗ”¢½ŗĢ唢×ĒŅŗŅ»¶Ø¶¼ŹĒ»ģŗĻĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ²āŹŌŹ±¼ä/h | 0 | 1 | 2 | 3 | 4 |
| ÓźĖ®µÄpH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com