
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源:物理教研室 题型:022
(2)在地壳中,深度每增加1千米,压力大约增加25250~30300kPa,在这样的压力下,较简单的硅酸盐会转化为复杂的硅酸盐。已知:钙长石、镁橄榄石、石榴子石的化学式分别为:CaAl2Si2O8,Mg2SiO4, CaMg2Al2Si3O12。
请用氧化物形式分别表示出化学式:
钙长石________,镁橄榄石________,石榴子石________。
写出钙长石与镁橄榄石反应转变成石榴子石的化学方程式________。
(3)常用玻璃含70%的SiO2、15%的Na2O和10%CaO及5%的其他成分。则该玻璃的近似化学式为________;应将石英砂、碳酸钠和石灰石按怎样的质量比配料?________。
查看答案和解析>>
科目:高中化学 来源: 题型:022
(1)硅晶体结构与金刚石结构相似,硅晶体结构中最小的硅环上有________个硅原子,二氧化硅晶体结构中,最小的环上有________个硅原子,________个氧原子。
(2)在地壳中,深度每增加1千米,压力大约增加25250~30300kPa,在这样的压力下,较简单的硅酸盐会转化为复杂的硅酸盐。已知:钙长石、镁橄榄石、石榴子石的化学式分别为:CaAl2Si2O8,Mg2SiO4, CaMg2Al2Si3O12。
请用氧化物形式分别表示出化学式:
钙长石________,镁橄榄石________,石榴子石________。
写出钙长石与镁橄榄石反应转变成石榴子石的化学方程式________。
(3)常用玻璃含70%的SiO2、15%的Na2O和10%CaO及5%的其他成分。则该玻璃的近似化学式为________;应将石英砂、碳酸钠和石灰石按怎样的质量比配料?________。
查看答案和解析>>
科目:高中化学 来源:2013届贵州省遵义四中高三第二次月考理科综合化学试卷(带解析) 题型:实验题
(16分)(1)(6分)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
①用接口字母标出各仪器连接的顺序 量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+ D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式:
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市八县高二上学期期末考试化学试卷(解析版) 题型:填空题
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)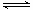 TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
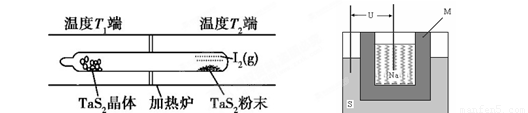
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________ ,Na2S溶液中c(H+)+ c(Na+)=________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年贵州省高三第二次月考理科综合化学试卷(解析版) 题型:实验题
(16分)(1)(6分) 测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
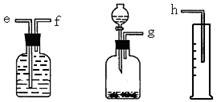
①用接口字母标出各仪器连接的顺序 量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+ D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com