
【题目】下列说法正确的是
A. SO2、Cl2均能使品红溶液永久性褪色
B. NH4HCO3晶体、固体碘受热均能变成气体都是因为升华
C. 铁分别与氯气、硫反应都生成含三价铁的化合物
D. OH-与Mg2+、Cu2+均因为生成难溶物而不能在溶液中大量共存
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.不可将水直接倒入浓硫酸中进行稀释
B.浓硫酸可用于干燥O2、CO2
C.硝酸与铁反应可产生H2
D.浓硫酸对皮肤或衣服有很强的腐蚀性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示。下列说法中不正确的是( )
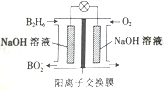
A. 正极的电极反应式为O2+4e-+2H2O=4OH- B. 电池工作时,Na+通过阳离子交换膜向右移动
C. 转移6mol电子理论上消耗乙硼烷的质量为14g D. 消耗1molB2H6时负极参与反应的n(OH-)为12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列物质的用途,叙述不正确的是
A. 浓硫酸可作干燥剂,可干燥SO2、Cl2、NH3等气体
B. 氨容易液化,常用作制冷剂
C. 硅胶可用于袋装食品或药品的干燥剂,也可用作催化剂的载体
D. Cl2、ClO2、O3均可用于自来水的杀菌、消毒剂,而明矾可作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如下装置(图中药品均足量):
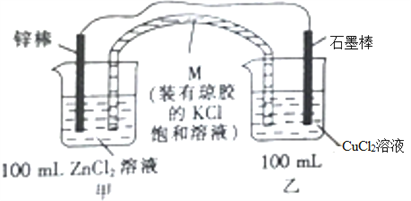
(1)M的名称是_________。
(2)烧杯乙中的现象是_____________________________。
(3)负极的电极反应式为____________________________________________,电池总反应的化学方程式为_____________。
(4)M的作用是向甲、乙两绕杯中提供K+或Cl-,以确保溶液呈电中性。当锌棒质量变化6.5g时,从M中进入装置乙内的离子是__________,其浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关科学家及其创建理论的描述中,错误的是
A.拉瓦锡阐明了质量守恒定律B.道尔顿创立分子学说
C.门捷列夫发现了元素周期律D.勒沙特列发现化学平衡移动原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
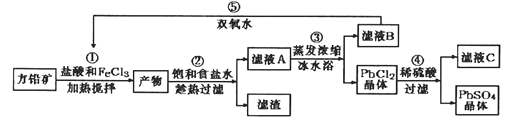
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)①中生成淡黄色沉淀的离子方程式是________________________________________________,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____________________。
(2)用化学平衡移动的原理解释③中使用冰水浴的原因是__________________
(3)上述流程中可循环利用的物质有_______________。
(4)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:
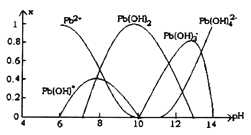
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
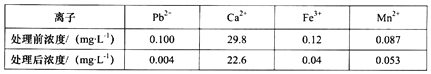
由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知磷酸分子(![]() )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
A. H3 PO2属于三元酸 B. H3 PO2的结构式为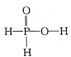
C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水.某小组在实验室中探究ClO2与Na2S的反应.回答下列问题:
(1)ClO2的制备(已知SO2+2NaClO3+H2SO4═2ClO2↑+2NaHSO4)置A中反应的化学方程式为 . ②欲收集干燥的ClO2 , 选择图1中的装置,其连接顺序为a→(按气流方向,用小写字母表示)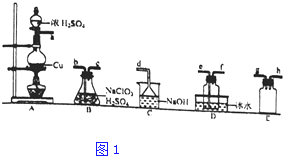
③装置D的作用是 .
(2)ClO2与Na2S的反应 将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入图2所示装置中充分反应,得到无色澄清溶液.一段时间后,通过下列实验探究I中反应的产物.
操作步骤 | 实验现象 | 结论 |
取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无_生成 |
另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ② | 有SO42﹣ |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中, | 有白色沉淀生成 | 有Cl﹣生成 |
④ClO2与Na2S反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com