
【题目】用1L1.0mol/L的NaOH溶液吸收0.8molSO2,所得溶液中的SO32-和HSO3-的物质的量之比为( )
A.1:3B.1:2C.2:3D.3:2
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】将过量的0.2g铜粉与5mL1 molL1FeCl3溶液混合,充分振荡,溶液棕黄色变浅,溶液变绿,有灰白色固体出现。通过查阅资料,初步认为灰白色固体可能含CuCl(CuCl白色晶体,不溶于水、硫酸、稀硝酸,溶于氨水、浓盐酸溶液中,生成络合物)。为进一步探究灰白色固体是否含CuCl,进行一系列实验。已知:① CuCl+2NH3H2O![]() [Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
请回答下列问题:
(1)生成CuCl的化学方程式____________________________________。
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是_______________。
A. B.
B. 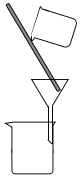 C.
C.![]() D.
D. E.
E. F.
F.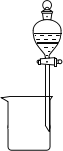
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有_______(填离子符号),理由是_____________________________________________。
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为____________________。
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H为某合成药物的中间体,其合成路线如下:

已知:
① R-CH=CH-CH3 ![]() R-CH=CH-CH2-Br
R-CH=CH-CH2-Br
② RCH=CH2+HBr![]() RCH2CH2Br
RCH2CH2Br
回答下列问题:
(1)A的结构简式为_______。H中含有的含氧官能团名称是__________。
(2)F→G的反应类型为__________,设计C→D的目的为___________。
(3)D→E反应的化学方程式为_____________________________。
(4)M和N与G互为同分异构体。M含有苯环,苯环上有2个支链,且苯环上一氯代物只有2种,遇FeCl3溶液显紫色,能与新制Cu(OH)2悬浊液反应生成砖红色沉淀,则M有_____种(不考虑顺反异构)。N为芳香族化合物,0.5molN与足量银氨溶液反应生成2molAg,核磁共振氢谱显示其峰面积比为1:2:2,则N的结构简式为________。
(5)参考上述合成路线,以丙烯为原料(无机试剂任选)设计制备![]() 的合成路线____________________。
的合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=___________________。
(2)在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH____0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是______(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)反应的平衡常数表达式K=_____________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。

(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是______ (填字母)。
a.v生成(CH3OH)= v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)______________。
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,四种均为0.1molL﹣1的溶液,其pH如下表所示:
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
下列关系不正确的是
A. 酸性:H2CO3 > ![]()
B. 水电离产生的c(H+):① = ②
C. 溶液③中:c(HCO3﹣)+ c(CO32﹣)+ c(H2CO3)= 0.1molL﹣1
D. 溶液④中:c(Na+)> c(![]() )> c(OH-)> c(H+)
)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中关于物质分类的正确组合是( )
组合类别 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | H2O2 | CH3COOH | KOH | CaCl2 |
D | CO2 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com