
| A. | 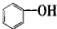 属于醇类化合物 属于醇类化合物 | B. | 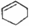 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 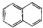 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2 属于链状化合物 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 已知N2和H2在一定条件下发生下列可逆反应:
已知N2和H2在一定条件下发生下列可逆反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
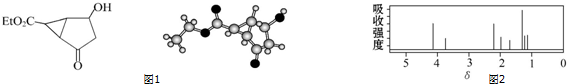
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能与金属钠、乙酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始时,正反应速率最大,逆反应速率为零 | |
| B. | 随着反应的进行,正反应速率逐渐减小,最后为零 | |
| C. | 随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 | |
| D. | 随着反应的进行,逆反应速率逐渐增大,最后与正反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
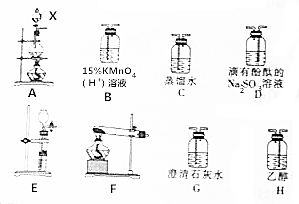 CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.
CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2-甲基-2-丁烯 | B. | 2-丁炔 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com