


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH为11的氨水与pH为3的盐酸等体积混合,溶液呈中性 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+c(Fe2+)═c(OH-)+c(SO42-) |
| C、向醋酸溶液中加入适量醋酸钠,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2mo1?L-1的Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| A、所涉及元素中原子半径:C>N>O |
| B、等物质的量N2和CO2中,共价键的个数比为3:4 |
| C、氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
| D、当x=2时,每生成1mol N2,转移电子数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 烯烃分子在一定条件下会发生二分子聚合,其实质是一个分子中饱和碳原子上的一个C-H键断裂,对另一个分子中的双键进行加成.也可以烯烃复分解反应.如:
烯烃分子在一定条件下会发生二分子聚合,其实质是一个分子中饱和碳原子上的一个C-H键断裂,对另一个分子中的双键进行加成.也可以烯烃复分解反应.如:
| 金属卡宾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
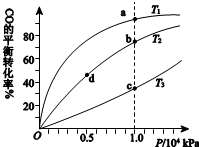 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( ) | A.温度: | T1>T2>T3 | |
| B.正反应速率: | υ(b)>υ(d) | υ(a)>υ(c) |
| C.平衡常数: | K(a)>K(c) | K(b)=K(d) |
| D.平均摩尔质量: | M(b)>M(d) | M(a)<M(c) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
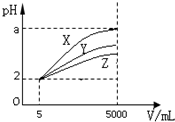 在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、若X、Y、Z都是弱酸,则a的值一定小于5 |
| B、三种酸的原来的浓度大小为X>Y>Z |
| C、稀释后X溶液中水的电离程度最小 |
| D、完全中和原X、Y两溶液时,消耗同浓度NaOH的体积 V(X)>V(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、充电时,阳极的电极反应式为Li1-xCoO2+xLi+xe-═LiCoO2 |
| B、充电时锂离子由阴极流向阳极 |
| C、放电时,负极的电极反应式为6C+xLi++xe-═Li2C6 |
| D、放电时锂离子由负极流向正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com