
| A. | 两种元素原子的电子层上全部都是s电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子 | |
| D. | M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子 |
分析 A、两原子的核外全部都是s电子,原子具有1s能级或具有1s、2s能级;
B、最外层电子排布为2s22p6的原子为氖原子,最外层电子排布为2s22p6的离子可能是阴离子也可能是阳离子;
C、3p上只有一个空轨道的原子,其外围电子排布为3s23p2,3p亚层上只有一个未成对电子的原子,其外围电子排布为3s23p1或3s23p5;
D、原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子,不能确定N层是否有电子排布,符合条件的原子为氩原子,钾原子,钙原子.
解答 解:A、两原子的核外全部都是s电子,原子具有1s能级或具有1s、2s能级,不处于同一周期,如氢原子与锂原子,故A错误;
B、最外层电子排布为2s22p6的原子为氖原子,最外层电子排布为2s22p6的离子可能是阴离子也可能是阳离子如O2-、Na+等,不一定处于同一周期,故B错误;
C、3p上只有一个空轨道的原子,其外围电子排布为3s23p2,3p亚层上只有一个未成对电子的原子,其外围电子排布为3s23p1或3s23p5,二者都处于第3周期,故C正确;
D、原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子,符合条件的原子的核外电子排布式有1s22s22p63s23p6为氩原子,1s22s22p63s23p64s1为钾原子,1s22s22p63s23p64s2为钙原子,不一定处于同一周期,故D错误;
故选C.
点评 本题考查核外电子排布规律,难度中等,掌握核外电子排布规律:①、每个轨道最多只能容纳两个电子,且自旋相反配对;②、能量最低原理:电子尽可能占据能量最低的轨道;③、简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子;另外:等价轨道在全充满、半充满或全空的状态是比较稳定的.


科目:高中化学 来源: 题型:解答题
| 装置 | 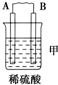 | 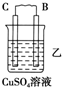 | 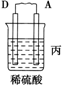 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
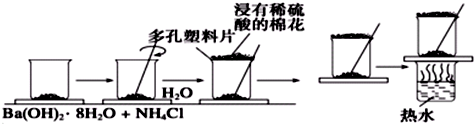
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| B. | 同种元素的原子均有相同的质子数和中子数 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使高锰酸钾酸性溶液褪色,甲烷和苯不能使高锰酸钾酸性溶液褪色 | |
| D. | 苯与硝酸在50~60°C发生取代反应,甲苯与硝酸在30°C就能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI.
.共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com