
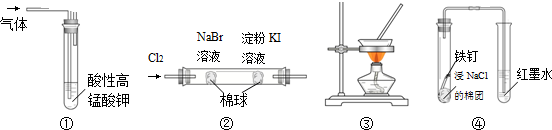
| A. | 图①装置可用于除去甲烷中混有的乙烯 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
分析 A.酸性高锰酸钾溶液具有强氧化性,能氧化乙烯生成二氧化碳;
B.未反应的Cl2能和KI反应生成I2;
C.蒸发过程中AlCl3水解生成氢氧化铝和HCl,升高温度促进HCl挥发,促进AlCl3水解;
D.如果Fe发生吸氧腐蚀,会导致左边试管中压强减小,右边试管导气管中液面发生变化.
解答 解:A.酸性高锰酸钾溶液具有强氧化性,能氧化乙烯生成二氧化碳,除去杂质又引进新的杂质,应该用溴水除去甲烷中的乙烯,故A错误;
B.未反应的Cl2能和KI反应生成I2,影响溴和KI的反应的检验,故B错误;
C.蒸发过程中AlCl3水解生成氢氧化铝和HCl,升高温度促进HCl挥发,促进AlCl3水解,蒸干得到的固体是Al(OH)3,故C错误;
D.如果Fe发生吸氧腐蚀,会导致左边试管中压强减小,右边试管导气管中液面会上升,所以图④装置可观察铁的吸氧腐蚀,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及除杂、物质检验、盐类水解、金属的腐蚀与防护等知识点,明确实验原理及物质性质是解本题关键,注意除杂时不能引进新的杂质,易错选项是AB.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | a、b不可能是同种材料的电极 | |
| B. | 该装置可能是原电池,也可能是电解池 | |
| C. | 该装置可能是原电池,电解质溶液为稀硝酸 | |
| D. | 该装置的电极可以是铜锌,电解质溶液是稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
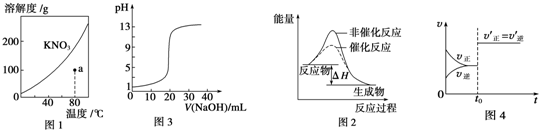
| A. | 图1表示KNO3的溶解度曲线,图中a点对应的溶液是80℃时KNO3的饱和溶液 | |
| B. | 图2表示某吸热热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示0.1000 mol•L-1 NaOH溶液滴定20.00 mL 0.1000 mol•L-1醋酸溶液的滴定曲线 | |
| D. | 图4表示t0时改变的条件可能是增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
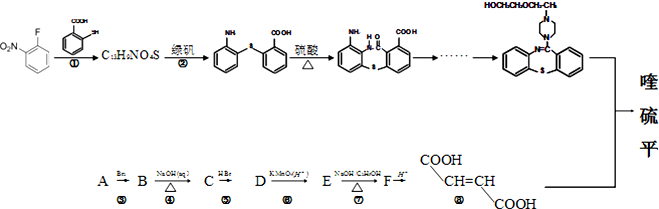
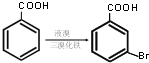 写出以甲苯为原料制备
写出以甲苯为原料制备 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 闭合K1,石墨电极表面产生Cl2 | |
| B. | 闭合K1,铁电极上发生还原反应 | |
| C. | 闭合K2,若铁被保护,则a为正极 | |
| D. | 闭合K2,若铁表面产生H2,说明发生了析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
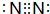 ;构成AlN的微粒是Al原子和N原子.
;构成AlN的微粒是Al原子和N原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中的二氧化硫超标 | B. | 空气中的氮氧化物超标 | ||
| C. | 空气中可吸入颗粒物超标 | D. | 空气中的二氧化碳超标 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R一定有4个电子层 | |
| B. | R原子的最外层电子数一定为6 | |
| C. | R的气态氢化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com