
| A、26Mg2+含有的中子数和电子数 |
| B、反应2Na2O2+2H2O═4NaOH+O2↑中,还原剂与氧化剂的物质的量 |
| C、惰性电极电解Na2SO4溶液,阴、阳两极析出物质的物质的量 |
| D、液面在0刻度时,50mL滴定管25mL滴定管所盛溶液的体积 |


科目:高中化学 来源: 题型:

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HNO3 ② |
③NaOH ④ |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧SO3 |
⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(OH)2的溶解度最小 |
| B、Ca(OH)2的溶解度最小 |
| C、AgCl的溶解度最小 |
| D、物质Ksp越大溶解度也越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,测得醋酸钠溶液的pH>7 |
| B、常温下,中和等物质的量浓度等体积的醋酸和盐酸溶液,消耗氢氧化钠溶液体积相等 |
| C、常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
| D、常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
| B、充电时阴极附近溶液的碱性增强 |
| C、放电过程是电能转化为化学能的过程 |
| D、放电时负极反应:Cd+2OH--2e-=Cd(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红 | ||
| B、Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 | ||
C、在氯化铵溶液中离子浓度大小顺序为c(Cl-)>c(N
| ||
| D、H2SO3的电离方程式为H2SO3?2H++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学计量数:m+n>p |
| B、平衡向正反应方向移动了 |
| C、物质B的转化率减小了 |
| D、物质C的质量分数增加了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入水时,平衡向逆反应方向移动 |
| B、加入少量CH3COONa固体,平衡向正反应方向移动 |
| C、加入少量0.1mol?L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)增大 |
| D、加入少量NaOH固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
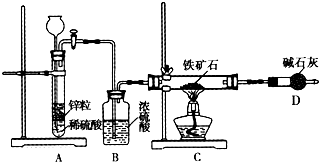

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com