
����Ŀ��������ԭ��Ӧ�������������о��й㷺����;��
��1�����������������е�������û�з���������ԭ��Ӧ����_____��ѡ��������
a. ��ˮ���� b. ��ҵ���ȼ� c. ��ˮɹ�� d. �������
��2��ˮ���������Ҫ��ɲ������������к�������һ�������������ֻ�����Ӧ������������ԭ��Ӧ�Ĺ���������ͼ��ʾ��

��д����ˮ�μ��ҷ��Ϸ�Ӧ���� IV ��һ����ѧ����ʽ��___________________��
��3����ҵ������NaIO3��NaHSO3��Ӧ����ȡ����I2��
����ƽ���л�ѧ����ʽ����������ת�Ƶķ������Ŀ��
_____NaIO3+ NaHSO3�� I2+ Na2SO4+ H2SO4+ H2O
���÷�Ӧ��ԭ����_____��_____Ԫ�ر���ԭ�������� 1mol ����������ת�Ƶ�����ĿΪ_____NA��
��4����֪��HSO3-��I2��I-��SO42-��һЩδ֪����ɵ�һ��������ԭ��Ӧ������SO42-����������÷�Ӧ�л�ԭ��HSO3-_____I-������������������������ɸ÷�Ӧ_____________________________________��
���𰸡� c 2F2+2H2O��4HF+O2��2Na+2H2O��2NaOH+H2����C+H2O![]() CO+H2
CO+H2 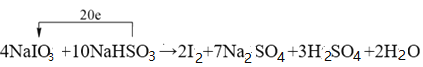 NaHSO3 I 2 �� H2O + I2+ HSO3����2I��+ SO42��+ 3H+
NaHSO3 I 2 �� H2O + I2+ HSO3����2I��+ SO42��+ 3H+
����������1��������Ԫ�ػ��ϼ������ķ�Ӧ����������ԭ��Ӧ������ѡ��ABD�ж��漰������ԭ��Ӧ��ѡ��C�������仯��һ������������ԭ��Ӧ����ѡC����2�����������ֻ�����Ӧ������������ԭ��Ӧ�Ĺ�ϵ��ͼ��֪�������û���Ӧ����˷��������Ŀ�����2F2+2H2O��4HF+O2 �� 2Na+2H2O��2NaOH+H2���� C+H2O![]() CO+H2����3������ѧ��Ӧ�е�Ԫ�ػ��ϼ۴�+5�۽�Ϊ0�ۣ�����1mol�ⵥ�ʹ�����10�ۣ���Ԫ�صĻ��ϼ۴�+4�����ߵ�+6�ۣ�2molNaHSO3����1molNa2SO4��������4�ۣ����ݵ����غ��ԭ���غ㣬������Ƶ�ǰ��ϵ����4�����������Ƶ�ϵ����10����4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O����Ӧ������2mol�ⵥ��ת��20mol���������ʴ�Ϊ��
CO+H2����3������ѧ��Ӧ�е�Ԫ�ػ��ϼ۴�+5�۽�Ϊ0�ۣ�����1mol�ⵥ�ʹ�����10�ۣ���Ԫ�صĻ��ϼ۴�+4�����ߵ�+6�ۣ�2molNaHSO3����1molNa2SO4��������4�ۣ����ݵ����غ��ԭ���غ㣬������Ƶ�ǰ��ϵ����4�����������Ƶ�ϵ����10����4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O����Ӧ������2mol�ⵥ��ת��20mol���������ʴ�Ϊ��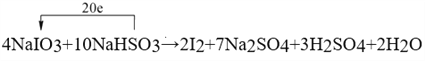 ������Ԫ�صĻ��ϼ����ߣ�����NaHSO3��������Ϊ��ԭ������������Ϊ�����ƺ�������IԪ�صĻ��ϼ۽��ͱ���ԭ�������� 1mol ����������ת�Ƶ�����ĿΪ
������Ԫ�صĻ��ϼ����ߣ�����NaHSO3��������Ϊ��ԭ������������Ϊ�����ƺ�������IԪ�صĻ��ϼ۽��ͱ���ԭ�������� 1mol ����������ת�Ƶ�����ĿΪ![]() ��NA=2NA����4����֪��HSO3-��I2��I-��SO42-��һЩδ֪����ɵ�һ��������ԭ��Ӧ������SO42-�����������HSO3-�ǻ�ԭ������Ԫ�ػ��ϼ����ߣ����Ԫ�ػ��ϼ۽��ͣ�I2Ϊ��������I-Ϊ��ԭ�����ѧ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�����Ӧ�л�ԭ��HSO3-��I-���ٽ��������ԭ��Ӧ��ƽԭ����ƽ���÷�ӦΪ��H2O + I2 + HSO3��=2I��+ SO42��+ 3H+��
��NA=2NA����4����֪��HSO3-��I2��I-��SO42-��һЩδ֪����ɵ�һ��������ԭ��Ӧ������SO42-�����������HSO3-�ǻ�ԭ������Ԫ�ػ��ϼ����ߣ����Ԫ�ػ��ϼ۽��ͣ�I2Ϊ��������I-Ϊ��ԭ�����ѧ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�����Ӧ�л�ԭ��HSO3-��I-���ٽ��������ԭ��Ӧ��ƽԭ����ƽ���÷�ӦΪ��H2O + I2 + HSO3��=2I��+ SO42��+ 3H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�¡�ͬѹ�£��������NH3��CH4�������壬����˵���������(����)
A. ����������Ŀ��ͬ
B. ������ԭ�����ʵ���֮��Ϊ3��4
C. ����֮��Ϊ16��17
D. �ܶ�֮��Ϊ17��16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ٺ������������ʾ����������Եõ���ˮ�����ˮ�м������Ȼ�̼����ȡ�ⵥ�ʵ�ʵ�������________���ò�����Ҫ�IJ���������________��
��ijNaCl��Ʒ�п��ܺ���SO42-��CO32-��Ϊ�����������ӵĴ��ڣ���ȡ����ʵ�鲽�裺��Ʒ![]() ����������
����������![]() �����������������Լ�AΪ_______��BΪ_______��������֤����Ʒ�в�����____��
�����������������Լ�AΪ_______��BΪ_______��������֤����Ʒ�в�����____��
���ں���ʵ������Ҫʹ��450mL0.5 mol��L- 1NaCl��Һ��Ϊ���Ƹ�Ũ��NaCl��Һ����ʵ�飬����������ƽ��ȡNaCl_______g������NaCl��Һʱ�����������в�������ʹ����Ũ��ƫ�ߵ�����_____��
A����ƽ���뼺��ʴ B�����ƹ�����δ������ˮϴ���ձ��Ͳ�����
C��ת����Һʱ����Һ���� D������ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013��3���ҹ���ѧ�ұ�������ͼ��ʾ��ˮ��Һ����ӵ����ϵ����������������ǣ� �� 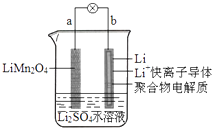
A.aΪ��ص�����
B.��طŵ練ӦΪLiMn2O4=Li1��xMn2O4+xLi
C.�ŵ�ʱ��a��﮵Ļ��ϼ۲������仯
D.�ŵ�ʱ����Һ�е�Li+��b��aǨ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��L��M����Ԫ�ص�ԭ��������������X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�أ�
�ش��������⣺
��1��L��Ԫ�ط���Ϊ��M��Ԫ�����ڱ��е�λ��Ϊ������Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳��������Ԫ�ط��ű�ʾ����
��2��Z��X��Ԫ�ذ�ԭ����Ŀ��l��3��2��4���ɷ���A��B��A�ĵ���ʽΪ �� B�ĽṹʽΪ ��
��3������se��������������Ԫ�أ���Lͬһ���壬Seԭ�ӱ�Lԭ�Ӷ��������Ӳ㣬��Se��ԭ������Ϊ �� ������������Ӧ��ˮ���ﻯѧʽΪ �� ����2��5����Ԫ�ص��ʷֱ���H2��Ӧ����l mol��̬�⻯��ķ�Ӧ�����£���ʾ����1mol�����ⷴӦ�ȵ���������ĸ���ţ���
a��+99.7molL��1 b��+29.7molL��1 c����20.6molL��1 d����241.8kJmol��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ӧ����1molˮ�����ų�241.8kJ��������1gˮ����ת��ΪҺ̬ˮ�ų�2.45kJ���������������Ȼ�ѧ����ʽ��д��ȷ���ǣ� ��
A.H2��g��+ ![]() O2��g��=H2O��l������H=��285.9 kJ/mol
O2��g��=H2O��l������H=��285.9 kJ/mol
B.H2��g��+ ![]() O2��g��=H2O��l������H=��241.8 kJ/mol
O2��g��=H2O��l������H=��241.8 kJ/mol
C.H2��g��+ ![]() O2��g��=H2O��l������H=+285.9 kJ/mol
O2��g��=H2O��l������H=+285.9 kJ/mol
D.H2��g��+ ![]() O2��g��=H2O��l������H=+241.8 kJ/mol
O2��g��=H2O��l������H=+241.8 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������AlCl3 ��Һ����μ���NaOH��Һ�����ɳ���Al��OH��3������NaOH�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ� �� 
A.a���Ӧ����Һ�У�K+��NH4+��I����CO32��
B.b���Ӧ����Һ�У�Na+��H+��S2����Cl��
C.c���Ӧ����Һ�У�NH4+��H+��NO3����SO42��
D.d���Ӧ����Һ�У�Na+��K+��SO42����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1989������������֯����ȷ��ΪʳƷ��ȾԴ֮һ�����Կ���ʹ�á���������Ӧ��ʱӦ���Կ��Ƶ���
�������Ͻ� ���Ƶ��� ���ƴ��� ��������ˮ ���������մ���ʳƷ���ɼ�
�������������������ӹ���θ��ƽҩƬ �������� ���װ�ǹ���СʳƷ
A. �ۢݢߢ� B. �ޢߢ� C. �ۢݢ� D. �ۢܢݢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0L�ܱ������з���0.10molX����һ���¶��·�����Ӧ��X��g���TY��g��+Z��g����H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�������ȷ���ǣ� �� 
A.�ӷ�Ӧ��ʼ��t1ʱ��ƽ����Ӧ����v��X��= ![]() ?mol/��L?min��
?mol/��L?min��
B.���¶��´˷�Ӧ��ƽ�ⳣ��K=0.32
C.�����ƽ����ϵ��Y�ĺ������ɽ�����ϵ�¶Ȼ����Z����
D.�����������䣬�ٳ���0.1 mol ����X��ƽ�������ƶ���X��ת��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com