
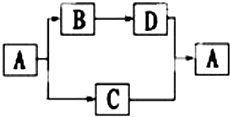
 A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):分析 (1)若A 是一种白色难溶于水的钙盐,由三种元素组成,C 是大气循环中的一种重要物质,则A为CaCO3,B为CaO,C为CO2,D为Ca(OH)2;
(2)若A是无色液体溶剂,D是一种黑色固体,则A为H2O,B为O2、C为H2、D为CuO;
(3)n(NaOH)=1L×1mol/L=1mol,1:2<n(CO2 ):n(NaOH)=0.6mol:1mol=3:5<1:1,反应生成Na2CO3、NaHCO3,根据碳元素、钠元素守恒列方程计算解答.
解答 解:(1)若A 是一种白色难溶于水的钙盐,由三种元素组成,C 是大气循环中的一种重要物质,则A为CaCO3,B为CaO,C为CO2,D为Ca(OH)2,C和D反应生成A的化学方程式是:CO2+Ca(OH)2=CaCO3+H2O,
故答案为:CaO;CO2+Ca(OH)2=CaCO3+H2O;
(2)若A是无色液体溶剂,D是一种黑色固体,则A为H2O,B为O2、C为H2、D为CuO,由B生成D的化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,
故答案为:H2;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(3)n(NaOH)=1L×1mol/L=1mol,1:2<n(CO2 ):n(NaOH)=0.6mol:1mol=3:5<1:1,反应生成Na2CO3、NaHCO3,令二者物质的量分别为xmol、ymol,根据碳元素、钠元素守恒,则:
$\left\{\begin{array}{l}{x+y=0.6}\\{2x+y=1}\end{array}\right.$,
解得x=0.4,y=0.2
答:反应生成Na2CO3、NaHCO3,二者物质的量分别为0.4mol、0.2mol.
点评 本题考查无机物推断、混合物计算,(3)中判断产物是关键,注意利用守恒法计算解答.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| B. | 探究“影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 氨水 | C. | AgNO3 溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | FeCl2溶液 | C. | FeCl3溶液 | D. | Fe(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H+(aq)+OH- (aq)═H2O(l);△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)═H2O(l)△H=-44.0kJ•mol-1可知是放热反应 | |
| C. | 由SO2(g)+0.5O2(g)═SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 由△G=△H-T△S可知,所有放热反应都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下列有关硅单质及其化合物的说法正确的是B.
(1)下列有关硅单质及其化合物的说法正确的是B.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氨水与稀盐酸反应:H++OH-═H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com