
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如下图所示:
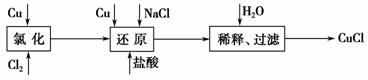
试回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是______________________________________________________________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式___________ ____________________________________________________________。
制备过程中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?
(已知Cu2++Cu+2Cl-===2CuCl)
___________________________________________________________。
(3)还原过程中加入少量盐酸的作用是________________________,加入过量NaCl的原因是___________________________________________________ ___________________________________________________。
(4)合成结束后所得产品用酒精淋洗的目的是___________________________ ___________________________________________________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式________________________________________ ______________________________________________________________。
解析 (1)主要从原料经济性的角度来回答。(2)产物Na[CuCl2]中Cu元素的化合价为+1价,因此还原过程发生的是归中反应。(3)主要考查盐类水解和化学平衡知识。(4)产品用酒精洗涤,是因为酒精沸点低,易挥发,产品易晾干,可防止CuCl被空气氧化。(5)反应中CuCl2被还原为CuCl,则SO2被氧化为H2SO4。
答案 (1)石灰乳来源丰富,成本低
(2)CuCl2+2NaCl+Cu===2Na[CuCl2] CuCl沉淀沉积Cu表面阻碍反应的进行
(3)防止Cu2+水解 增大NaCl的浓度有利于生成更多Na[CuCl2],提高产率
(4)使CuCl尽快干燥,防止其被空气氧化
(5)2Cu2++2Cl-+SO2+2H2O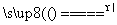 2CuCl↓+4H++SO
2CuCl↓+4H++SO


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是 ( )。
A.Na2SiO3 B.Na2CO3、Na2SiO3
C.Na2CO3、SiO2 D.SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO |
| 阳离子 | Al3+、Fe3+、Mg2+、NH |

现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则Oa段转化为沉淀的离子(指来源于X溶液的,下同)是_______________________________________________________________,
ab段发生反应的离子是________,bc段发生反应的离子方程式为________________________________________________________________。
(2)若Y是NaOH溶液,则X中一定含有的离子是________,ab段反应的离子方程式为_______________________________________________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法正确的是 ( )。

A.相对于途径②,途径①更好地体现了绿色化学思想
B.Y可以是葡萄糖溶液
C.X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________;Y与过量浓硝酸反应后溶液中含有的盐的化学式为______________________________________________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________。
A.Mg2+ B.Fe2+
C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
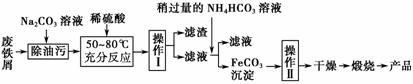
回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________;操作Ⅱ的方法为______________________________________________________________。
②请写出生成FeCO3沉淀的离子方程式:_________________________ _______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是 ( )。
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加稀BaCl2溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
恩格斯指出:“新创立的有机化学,它一个一个的从无机物创造出所谓的有机化合物,从而扫除了这些所谓有机物神秘性的残余。”
(1)请举例说明有机物和无机物之间是可以相互转化的(用化学方程式表示):
①有机物转化为无机物___________________________________。
②无机物转化为有机物________________________________。
(2)1828年,德国化学家维勒在制备无机盐氰酸铵(NH4CNO,一种无机化合物,由氯化铵和氰酸银反应制得)水溶液时得到尿素[CO(NH2)2]。尿素的人工合成,揭开了人工合成有机物的序幕。请回答下列问题:①制备氰酸铵的化学方程式是__________________。
②氰酸铵和尿素间的关系是________(填字母代号)。
A.同位素 B.同素异形体
C.同分异构体 D.同系物
③尿素在尿素酶的作用下能够水解生成碳酸铵,写出该反应的化学方程式
________________________________________________________________________。
(3)现代工业上用氨和二氧化碳在200个大气压和180℃时反应合成尿素,请写出该反应的化学方程式: ________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com