
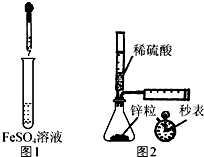
| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤 | |
| D. | 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象 |
分析 A.Fe(OH)2不稳定,易被空气氧化生成Fe(OH)3;
B.测定一定时间内收集气体体积或测定收集一定体积气体所用时间来测定氢气的生成速率;
C.苯酚和溴发生取代反应生成三溴苯酚测定,三溴苯酚、苯和溴能互溶;
D.葡萄糖和新制氢氧化铜悬浊液的反应需要在碱性条件下.
解答 解:A.Fe(OH)2不稳定,易被空气氧化生成Fe(OH)3,为防止氢氧化亚铁被氧化,应该将胶头滴管插入溶液中,故A错误;
B.测定一定时间内收集气体体积或测定收集一定体积气体所用时间来测定氢气的生成速率,该实验符合条件,能实现实验目的,故B正确;
C.苯酚和溴发生取代反应生成三溴苯酚测定,三溴苯酚、苯和溴能互溶,应该用NaOH溶液除去苯中的苯酚,然后采用分液方法分离提纯,故C错误;
D.葡萄糖和新制氢氧化铜悬浊液的反应需要在碱性条件下,所以该实验在加入新制氢氧化铜悬浊液之前必须加入NaOH溶液中和未反应的稀硫酸,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及化学反应速率、物质制备、除杂、物质检验等知识点,明确实验原理及物质性质水解本题关键,注意从实验操作规范性、物质性质及其差异性、实验评价方面分析解答,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | CH3COONH4、H2O、水晶 | B. | H2SO4、硫磺、石墨 | ||
| C. | KOH、SO3、Ar | D. | Ba(OH)2、玻璃、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
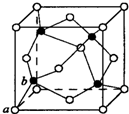 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的最外层电子数是最内层电子数的2倍 |
| C元素原子的核外p电子数比s电子数少1 |
| D 原子的第一至第四电离能分别是: I 1=578kJ•mol-1I 2=1817kJ•mol-1 I 3=2745kJ•mol-1I 4=11575kJ•mol-1 |
| E原子核外所有p轨道全满或半满 |
| F元素的主族序数与周期序数的差值为4 |
| G 是前四周期中电负性最小的元素 |
| H在周期表的第12列 |
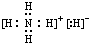 .
.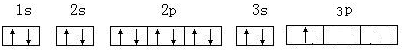 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
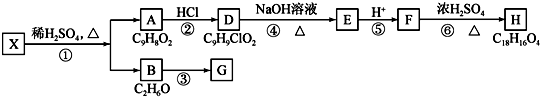
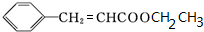 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$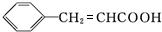 +CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
+CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.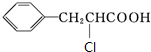 .
.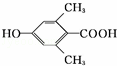 、
、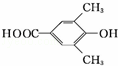 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 中和滴定时,锥形瓶先用蒸馏水润洗,再用待测液润洗 | |
| B. | 检验某溶液中含有Na+无K+时,用洁净的铂丝蘸取该溶液,灼烧,观察火焰颜色 | |
| C. | 用图1所示装置,将Cl2和HCl的混合气体通过饱和NHCO3溶液,除去Cl2中HCl | |
| D. | 用图2所示装置,向含有少量水的乙醇中加入足量生石灰,蒸馏,得到无水乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,则样品已变质 | |
| B. | NaBr溶液中滴入少量氯水和CCl4,震荡,有机相呈橙色,则还原性:Br->Cl- | |
| C. | 某试液中滴入BaCl2溶液和稀硝酸有白色沉淀,则试液中一定含SO42-或SO32- | |
| D. | 溴乙烷与NaOH的乙醇溶液共热,逸出的蒸气直接通入酸性高锰酸钾溶液,溶液紫色褪去,则逸出的蒸气一定为纯净的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 盐酸的浓度 | 反应温度 | 铝片消失的时间 |
| ① | 0.1mol/L | 20℃ | 400s |
| ② | 0.2mol/L | 20℃ | 200s |
| ③ | 0.2mol/L | 30℃ | 50s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 | B. | 0.02 mol•L-1 | C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com