
无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3,还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2===4AlCl3+3O2
回答以下问题:
(1)Cl-的电子式为 ________。Al在元素周期表最中的位置是________。
(2)生产中加入石油焦,其目的是_____________________________________。
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2  AlCl3+X↑,设计实验确定气体X的成分:
AlCl3+X↑,设计实验确定气体X的成分:
____________________________________________________________。
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为 _____________________________________________________________。
(5)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式__________________________、___________。
②AlCl3产品的纯度为__________________________________。
(6)以铝土矿为原料可以通过以下途径提纯氧化铝

①写出滤液甲中溶质的化学式______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式__________________。
(1) 第三周期第IIIA族
第三周期第IIIA族
(2)碳与O2反应,有利于反应正向进行
(3)气体X可能为CO、CO2或两者的混合物。将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO。
(4)Al + 3FeCl3 AlCl3 + 3FeCl2
AlCl3 + 3FeCl2
(5)①Fe3++3OH-===Fe(OH)3↓
Al3++4OH-===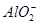 +2H2O
+2H2O
②96%
(6)①NaAlO2、Na2SiO3、NaOH
②Al3++3NH3·H2O ===Al(OH)3↓+3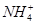
【解析】(1)在写阴离子的电子式时注意不要忘记写中括号和中括号外的电荷符号。
(2)从生产无水AlCl3的化学方程式看,该反应为可逆反应,加入石油焦后,碳与O2反应,使可逆反应转化为不可逆反应,有利于反应正向进行。
(3)从Al2O3+C+Cl2 AlCl3+X↑可以看出X为CO、CO2或两者的混合物,确定气体X的成分,就是检验CO、CO2的存在
AlCl3+X↑可以看出X为CO、CO2或两者的混合物,确定气体X的成分,就是检验CO、CO2的存在
(4)Al 将FeCl3还原为FeCl2
(5)过程中涉及的离子方程式有AlCl3与过量的NaOH溶液的反应和FeCl3与NaOH溶液的反应 ,0.32 g残留固体质量是Fe2O3, 则n(Fe3+) = 0.004 mol,m(FeCl3)=0.65 g ,m(AlCl3)=15.6 g, AlCl3产品的纯度为15.6 g /16.25 g = 0.96
(6)过量NaOH溶液可以和铝土矿中的Al2O3和SiO2 反应,不与Fe2O3反应


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |

A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测H2S 和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
右图所示装置中,a、b、c、d、e、f均为惰性电极,电解质溶液均足量。接通电源后,d极附近显红色。下列说法正确的是

A.电源B端是正极
B.a、c电极均有单质生成,其物质的量之比为2:1
C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液
D.f极附近变红,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:选择题
金属锌为活泼金属,易被腐蚀。下列关于锌的腐蚀说法正确的是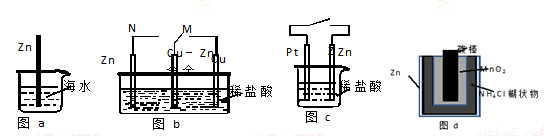
A.图a中,??入海水中的锌棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由Zn的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
2013年CCTV-4报道地球空气温度和30年前相比升高1.5 ℃左右,为控制温室效应,可以将二氧化碳转化为化工原料,如在适当的条件下,二氧化碳和氢气以1︰3的体积比进行反应,可生成某类重要的化工原料和水,则该类化工原料不可能是
A.甲醇(CH3OH)
B.乙烯
C.乙醇
D.甲烷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
25 ℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=l×l06,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=l×10-13 mol/L
B.由pH=4的HA与pH=10的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH一)>c(H+)
C. 浓度均为0.1 mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中c(H+)+c(Na+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合4 题型:简答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu + H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度T2小于T1
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
下图所示的实验方法、装置或操作完全正确的是 ( )
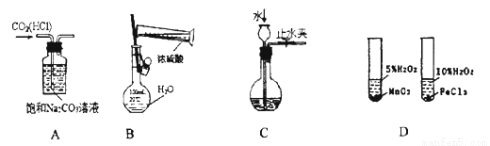
A.除去CO2中的HCl B.稀释浓H2SO4
C.检查装置气密性 D.研究不同催化剂对反应速率的影响
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版复习专练1气体定量测定在实验中应用练习卷(解析版) 题型:实验题
某课外兴趣小组为探究某种合金(含Mg、Al)中铝的含量,设计如图装置进行实验。

(1)如何检查该装置的气密性? 。
(2)写出该合金与氢氧化钠溶液反应的离子方程式: 。
(3)使足量氢氧化钠溶液与a g合金(固体M)充分反应,进入量气管的气体体积为V mL(已换算成标准状况,下同)。若a=0.036,V=22.4,该合金中铝的质量分数是 。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,与a g合金粉末充分反应,则进入量气管内的气体体积 (填“>”、“<”或“=”)V mL;利用测得的气体体积能否对合金中的Al含量进行计算? (填“能”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com