
【题目】已知:还原性强弱:I- >Fe2+>Br-,向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
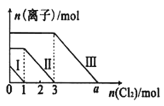
A.a值等于6
B.线段Ⅰ代表Br-的变化情况
C.线段Ⅲ代表Fe2+的变化情况
D.原混合溶液中n(FeBr2)=4mol
【答案】A
【解析】
向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性强弱:I->Fe2+>Br-,首先发生反应:2I-+Cl2=I2+2Cl-,I-反应完毕,再发生反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应:2Br-+Cl2=Br2+2Cl-,故线段Ⅰ代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;通入氯气,根据反应离子方程式,n(I-)=2n(Cl2)=2mol,n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒,n(I-)+ n(Br-)=2n((Fe2+),故n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,据此分析作答。
A.溶液中n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,A正确;
B.线段Ⅰ代表I-的变化情况,B错误;
C.线段Ⅲ代表Br-的变化情况,C错误;
D.n((Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,而n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,则原混合溶液中n(FeBr2)=![]() n(Br-)=3mol,D错误;
n(Br-)=3mol,D错误;
故答案为:A。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)_____________________________________
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是________________________________
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸钾溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
实验步骤 | 预期现象和结论 |
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 | |
步骤2:取适量步骤1所得溶液于试管中 加入少量的____________________溶液。 | 若溶液褪色,说明其有_________若溶液不褪色,说明其中没有______ |
步骤3: 再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴 加___________溶液。 | 如果有白色沉淀生成,则说明其中有_____________,已经变质。 如果没有白色沉淀生成,则说明其中 没有_____________ |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2molL-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入____________,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05molL-1酸性高锰酸钾装入50ml__________(填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数=______________(只列出计算式,不要求算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
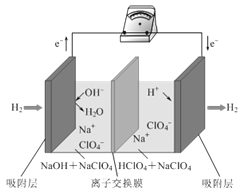
A.“全氢电池”工作时,将化学能转化为电能
B.电池的总反应是2H2+O2=2H2O
C.负极的电极反应是H2-2e-+2OH-=2H2O
D.电解质溶液中Na+向右移动,ClO4-向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置模拟侯氏制碱法的主要反应原理。下列说法正确的是
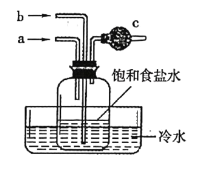
A.侯氏制碱法中可循环利用的气体为![]()
B.先从a管通入NH3,再从b管通入CO2
C.为吸收剩余的NH3,c中应装入碱石灰
D.反应后冷却,瓶中析出的晶体主要是纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种副作用小的新型镇痛消炎药K的合成路线如图所示:
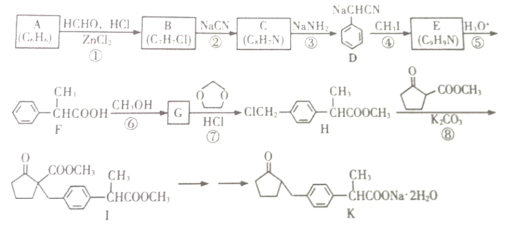
请回答下列问题
(1)F分子中官能团的名称为______________;B分子中处于同一平面的原子最多有____个
(2)反应⑥的条件为_______________;反应⑧的类型为_______________________。
(3)反应⑦除生成H外,另生成一种有机物的结构简式为_______________________。
(4)反应①的化学方程式为_______________________。
(5)符合下列条件的G的同分异构体有_____________种
Ⅰ.苯环上有且仅有四个取代基;
Ⅱ.苯环上的一氯代物只有一种;
Ⅲ.能发生银镜反应。
其中还能发生水解反应的同分异构体的结构简式为______________(只写一种即可)。
(6)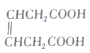 是合成
是合成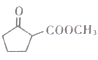 的重要中间体。参照题中合成路线,设计由1,3-丁二烯合成
的重要中间体。参照题中合成路线,设计由1,3-丁二烯合成![]() 的一种合成路线(无机试剂任选):_______________。
的一种合成路线(无机试剂任选):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸
B. 无机含氧酸分子中含有几个羟基,它就属于几元酸
C. 同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强
D. H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出相关的反应方程式:
(1)由可溶性铝盐制取氢氧化铝,需加入的试剂为:________;反应方程式为:_____________。
(2)白色的Fe(OH)2在空气中发生的颜色变化为___________。反应的化学方程式为:________。
(3)氯气与铁反应:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com