
A—I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为 B、C、D第一电离能由小到大的顺序为 (填写元素符号)
 (2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
(2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
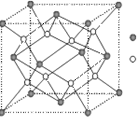
(3)D与G可以形成右图的晶胞,则黑点表示的是 元素(填写元素符号),该元素原子在该晶胞中的配位数为
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为 ,若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,该晶胞中成键原子键角为 。
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为 如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为 。(阿伏加德罗常数用NA表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为 。
【知识点】核外电子排布、电离能、晶胞结构 E1 E4 E5
【答案解析】(1)1:2(1分) ONF(1分)
(2)3d64s2 (1分) CO2(CS2 N2O)等合理答案都可以(1分)直线形(1分)
(3)Ca (1分) 8 (1分) (4)ZnS (2分) 109o28′(1分)
(5)74% (1分); 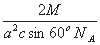 (2分)
(2分) 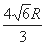 (2分)
(2分)
解析:A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,则A原子只能有2个电子层,最外层电子数为4,则A为碳元素;D为周期表中电负性最大的元素,则D为氟元素;H为应用最广泛的金属,则H为Fe;I处于周期表中的第二副族,则I为Zn.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,结合原子序数可知,处于ⅡA族,E为Mg、G为Ca;结合原子序数可知,B为N元素、C为O元素;F与C位于同一主族,F的原子序数小于Ca,则F为S元素,
(1)B单质为N2,分子中形成N≡N三键,含有1个σ键、2个π键,σ与π键数目比为1:2;同周期随原子序数增大第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于氧元素,故N、O、F第一电离能由小到大的顺序为O<N<F;
(2)H为Fe元素,原子的价层电子排布式为3d64s2,Fe3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物,该阴离子为SCN-,又与A-I元素中的某些原子形成的分子互为等电子体,等电子体含有相同的原子数目与价电子总数,该分子为CO2等,价电子总数相同的等电子体空间结构相似,故SCN-与CO2的空间结构相似为直线型;
(3)F与Ca可以形成CaF2,其晶胞中黑色球数=4 白色球数目=8,故黑色球代表Ca元素,由晶胞结构可知,应该F原子周围有4个Ca原子,即F原子配位数为4,则该Ca原子在该晶胞中的配位数为8,(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),则圆圈数目为4,黑色球数目晶胞中原子数目为1:1,并将小点和圆圈对应的元素更改为另外两种元素,符合ZnS的立方结构,则这个晶胞化学式为ZnS,
若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,由晶胞结构(类似金刚石结构)可知,每个原子周围连接4个原子,形成正四面体型,该晶胞中成键原子键角为109°28′,
5)已知,S单质晶体的原子堆积为ABAB型,为六方最密堆积,晶胞如图: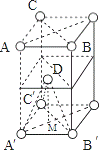 ,
,
D、C′、A′、B′彼此原子相邻,构成正四面体结构,晶胞的高度为该正四面体高的2倍,如果F的原子半径为R,则DA′长为2R,正四面体的高DM,M为正三角形A′B′C′的中心,则A′M的长为 ,则DM的长=
,则DM的长=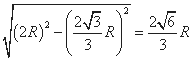 ,
,
故晶胞的高度=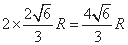 ;S(△A′B′C′)=
;S(△A′B′C′)=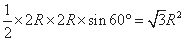 ,故底面面积为
,故底面面积为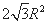 ,晶胞的体积=
,晶胞的体积=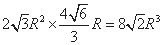 ,晶胞中含有原子数目为1+8×1/8=2
,晶胞中含有原子数目为1+8×1/8=2
,故原子总体积=2×4/3×πR3,故晶胞空间利用率=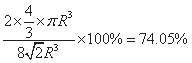 ;
;
如果F单质的摩尔质量为M,晶胞的质量=2M/NA,晶胞棱长为a,则S(△A′B′C′)=1/2a×a×sin60°=1/2a2sin60°,故底面面积为a2sin60°,晶胞高度为c,则晶胞体积=ca2sin60°,故晶体密度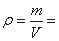
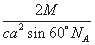
【思路点拨】
本题考查物质结构与性质,涉及核外电子排布、电离能、晶胞结构与计算等,题目计算量大,对学生的空间想象与数学计算有较高的要求,(4)(5)为易错点、难点


科目:高中化学 来源: 题型:
Ⅰ.某烃的结构简式为CH3C(CH3)2CH2CH(C2H5)CH2CH3
(1)该烃的名称为 ;
(2)若该烃是由某烯烃(含一个碳碳双键)和氢气加成而来,则烯烃的结构有 种;(3)若该烃是由某炔烃(含一个碳碳三键)和足量氢气加成而来,则炔烃的名称
为 炔 .
Ⅱ.同分异构现象是有机物种类繁多的原因之一,C10H14的同分异构体甚多,在苯的同系物的同分异构体中:
(1)苯环上只有一个烃基的同分异构体有 种;
(2)苯环上只有二个烃基的同分异构体有 种;
(3)苯环上只有三个烃基的同分异构体有 种;
(4)苯环上只有四个烃基的同分异构体有 种;
Ⅲ.苯分子中的氢原子分别被氟、氯、溴原子所取代得到C6H3BrClF分子的同分异构体有 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)⇌2AB2(g)△H<0,下列说法正确的是( )
|
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 |
|
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
|
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
|
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)电镀是将镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法: 。
(3)酸浸法制取硫酸铜的流程示意图如下:

①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为 。
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1molMnO2转移2 mol电子,该反应的离子方程式为:
。
④步骤(iv)除去杂质的化学方程式可表示为
3Fe3++NH4++2SO42-+6H2O=NH4Fe3(SO4)2(OH)6↓+6H+,过滤后母液的pH=2.0,
c(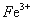 )=a mol·L—1,c(
)=a mol·L—1,c( )=b mol·L—1,c(
)=b mol·L—1,c(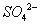 )=d mol·L—1,
)=d mol·L—1,
该反应的平衡常数K= (用含a、b、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
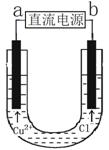
用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是
A.通电使CuC12发生电离
B.a端是直流电源的负极
C.阳极上发生的反应:Cu2++2e- == Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
2011年3月日本地震引起福岛核电站事故后,引起很多恐慌,人们担心受到核污染.按照国际规定,凡是可能形成和污染的物品与场所,以及有危险的药品和试剂,都必须张贴各种警示标志,以提醒大家注意防护.下列标志中用于表示辐射标志的是()
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
下面关于电解质的叙述中错误的是()
A. 在水溶液中或熔融状态下均不导电的化合物叫非电解质
B. 电解质、非电解质都指化合物而言,单质不属于此范畴
C. 电解质在水中一定能导电,在水中导电的化合物一定是电解质
D. BaSO4不溶于水,但BaSO4是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象的描述不正确的是()
A. 氢气在氯气中燃烧发出苍白色火焰,在瓶口有白雾生成
B. 红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加入少量水形成蓝色溶液
C. 金属Na在氯气中燃烧产生淡黄色的烟
D. 红热的铁丝在氯气中燃烧产生红棕色的烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com