
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
分析 还原性:SO32->I-.向含有amolKI和amolK2SO3的混合液中通入bmolCl2充分反应,故氯气先和SO32-反应,当SO32-反应完全后,氯气再和I-反应.而amolK2SO3完全反应时能消耗amol氯气,amolKI完全反应时能消耗$\frac{a}{2}$mol氯气.即当amolKI和amolK2SO3完全反应时,共消耗1.5amol氯气.
A、当a≥b时,氯气的量不足,只能氧化SO32-为硫酸根;
B、当5a=4b即a=0.8b时,0.8bmolSO32-消耗0.8bmol氯气,剩余的0.2bmol氯气能氧化0.4bmolI-为I2,据此分析;
C、当a≤b≤1.5a时,氯气能将全部SO32-氧化为硫酸根,氯气可能完全反应;
D、当a<b<1.5a时,SO32-全部被氧化为硫酸根,而I-不能全部被氧化.
解答 解:还原性:SO32->I-.向含有amolKI和amolK2SO3的混合液中通入bmolCl2充分反应,故氯气先和SO32-反应,当SO32-反应完全后,氯气再和I-反应.而amolK2SO3完全反应时能消耗amol氯气,amolKI完全反应时能消耗$\frac{a}{2}$mol氯气.即当amolKI和amolK2SO3完全反应时,共消耗1.5amol氯气.
A、当a≥b时,氯气的量不足,只能氧化SO32-为硫酸根,氯气被还原为氯离子,故离子方程式为SO32-+Cl2+H2O=SO42-+2H++2Cl-,故A正确;
B、当5a=4b即a=0.8b时,0.8bmolSO32-消耗0.8bmol氯气,被氧化为0.8bmolSO42-,0.2bmol氯气能氧化0.4bmolI-为I2,故离子方程式为:4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-,故B正确;
C、当a≤b≤1.5a时,氯气能将全部SO32-氧化为硫酸根,氯气可能完全反应,故转移的电子的物质的量为2mol≤n(e-)≤3amol,故C错误;
D、当a<b<1.5a时,SO32-全部被氧化为硫酸根,而I-不能全部被氧化,故溶液中硫酸根的物质的量为amol,消耗的氯气为amol,故剩余的氯气为(b-a)mol,则能氧化的电离子的物质的量为2(b-a)mol,故溶液中的碘离子的物质的量为a-2(b-a)=(3a-b)mol,由于氯气完全反应,故溶液中的氯离子的物质的量为2bmol,故溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b,故D正确.
故选C.
点评 本题考查了氧化还原反应中的反应先后顺序和与量有关的离子方程式的书写,难度不大,应注意的是由于还原性:SO32->I-,故氯气先和亚硫酸根反应,然后再和碘离子反应.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅单既能与氢氧化钠反应又能与氢氟酸反应,所以硅具有两性 | |
| C. | 晶体硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cs显+3价 | |
| B. | CsICl2溶于水,电离生成:Cs+、I-、Cl- | |
| C. | 酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水可鉴别苯、乙醇、苯乙烯 | |
| B. | 将乙烷和氯气的混合气放在光照条件下反应制备氯乙烷(C2H5Cl) | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 检验氯代烃中含氯,加NaOH溶液加热后,用稀硫酸酸化,再检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
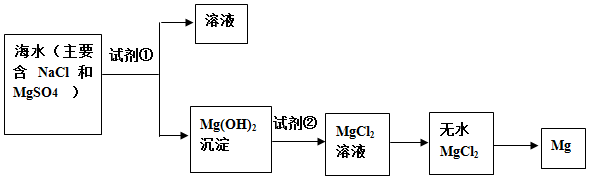
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往碳酸钙溶液中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 向次氯酸钙溶液通入少量SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| C. | 少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com