
【题目】请按如图所示要求,完成下列实验:
实验①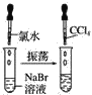
实验②
实验③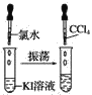
(1)实验①静置后,观察到实验现象是__,反应的化学方程式是__。
(2)实验②静置后,观察到实验现象是__,反应的化学方程式是__。
(3)实验③静置后,观察到实验现象是__,反应的化学方程式是__。
(4)通过上述实验可知,卤素单质氧化性由强到弱的顺序是__,卤素阴离子的还原性由强到弱的顺序是__。
【答案】液体分层,上层无色,下层橙红色 2NaBr+Cl2=2NaCl+Br2 液体分层,上层无色,下层紫红色 2KI+Br2=2KBr+I2 液体分层,上层无色,下层紫红色 2KI+Cl2=2KCl+I2 Cl2>Br2>I2 Cl-<Br-<I-
【解析】
(1)实验①中氯气能氧化NaBr生成NaCl和Br2;
(2)实验②中Br2能氧化KI生成KBr和I2;
(3)实验③中氯气能氧化KI生成KCl和I2;
(4)自发的氧化还原反应中氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物。
(1)实验①中氯气能氧化NaBr生成NaCl和Br2,发生反应的化学方程式是2NaBr+Cl2=2NaCl+Br2,则可观察到实验现象是液体分层,上层无色,下层橙红色;
(2)实验②中Br2能氧化KI生成KBr和I2,发生反应的化学方程式是2KI+Br2=2KBr+I2,则观察到实验现象是液体分层,上层无色,下层紫红色;
(3)实验③中氯气能氧化KI生成KCl和I2,发生反应的化学方程式是2KI+Cl2=2KCl+I2,则观察到实验现象是液体分层,上层无色,下层紫红色;
(4)由2NaBr+Cl2=2NaCl+Br2可知氧化性:Cl2>Br2,还原性:Br->Cl-;由2KI+Br2=2KBr+I2可知氧化性:Br2 >I2,还原性:I->Br-;由2KI+Cl2=2KCl+I2可知氧化性:Cl2>I2,还原性:I->Cl-;则卤素单质氧化性由强到弱的顺序是Cl2>Br2>I2,卤素阴离子的还原性由强到弱的顺序是Cl-<Br-<I-。


科目:高中化学 来源: 题型:
【题目】下列有关实验说法,不正确的是( )
A.苯酚不慎沾到皮肤上,应立即用酒精洗涤,再用大量水冲洗
B.排除碱式滴定管尖嘴的气泡时,应挤压玻璃球,使液体快速流出,向下冲出气泡
C.可用新制的![]() 悬浊液检验牙膏中存在的甘油
悬浊液检验牙膏中存在的甘油
D.利用硝酸银、稀硝酸可鉴别![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:![]() ,下列说法错误的是( )
,下列说法错误的是( )
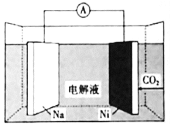
A.放电时,Na为电池的负极
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:![]()
D.充电时,阳极释放6.72L CO2时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
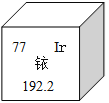
A. 铱的相对原子质量为192.2克
B. 铱原子核内的中子数为77
C. K2IrO3中Ir的化合价为+4
D. 生活中常用的铱金笔为纯净的铱单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对应的离子方程式正确的是( )
A.酸性高锰酸钾溶液和草酸溶液反应:2![]() +16H++5
+16H++5![]() ═2Mn2++10CO2↑+8H2O
═2Mn2++10CO2↑+8H2O
B.向氯化铁溶液中通入过量二氧化硫:2Fe3++3SO2+6H2O═2Fe+3![]() +12H+
+12H+
C.银和稀硝酸反应:3Ag+4H++![]() ═3Ag++2H2O+NO↑
═3Ag++2H2O+NO↑
D.向氯水中加入碳酸钠:Cl2+![]() ═Cl-+ClO-+CO2↑
═Cl-+ClO-+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素,原子序数依次增大,其中C、D、E同周期,A、C同主族,B、E同主族,B元素的原子最外层电子数是次外层电子数的三倍,又知A单质是密度最小的气体。
请回答下列问题:
(1)元素C在周期表中的位置______________________________。
(2)A、C、E以原子个数比1∶1∶1形成化合物X,其电子式为_________________。
(3)B、E对应简单氢化物稳定性的大小顺序是(用分子式表示) ________________。
(4)若D是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气.下列说法正确的是
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 合金在吸氢过程中被H2还原
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)> V(合金)>V(铝)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com