
【题目】高纯氧化铁是现代电子工业的重要材料.以下是用硫酸厂产生的烧渣![]() 主要成分为
主要成分为![]() 、
、![]() 、FeO、
、FeO、![]() 为原料制备高纯氧化铁
为原料制备高纯氧化铁![]() 软磁
软磁![]() 的生产流程示意图,下列说法不正确的是
的生产流程示意图,下列说法不正确的是![]()
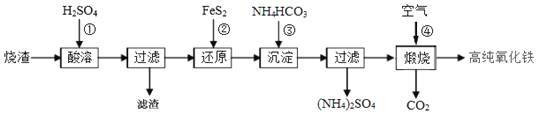
A.酸浸时,常需将烧渣粉碎、并加入过量![]() ,其目的是提铁元素的浸出率,同时抑制铁离子的水解
,其目的是提铁元素的浸出率,同时抑制铁离子的水解
B.加入![]() 时,发生反应
时,发生反应![]() 的离子方程式为
的离子方程式为![]()
C.加入![]() 为了生成
为了生成![]() ,检验
,检验![]() 是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净
是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净
D.煅烧时空气中的氧气作氧化剂,所以用氯气代替空气也可得到高纯氧化铁
【答案】D
【解析】
根据题中生产流程示意图可知,本题考查工业制备高纯氧化铁,运用铁及其化合物的性质分析。
![]() 烧渣
烧渣![]() 主要成分为
主要成分为![]() 、
、![]() 、FeO、
、FeO、![]() ,酸浸时与稀硫酸反应得到
,酸浸时与稀硫酸反应得到![]() 、
、![]() ,酸浸时,常需将烧渣粉碎,通过增大接触面积,提高铁元素的浸出率,因亚铁离子、铁离子都易水解呈酸性,通过加入过量
,酸浸时,常需将烧渣粉碎,通过增大接触面积,提高铁元素的浸出率,因亚铁离子、铁离子都易水解呈酸性,通过加入过量![]() ,抑制铁离子的水解,故A正确;
,抑制铁离子的水解,故A正确;
B.滤液中加入![]() 将
将![]() 还原为
还原为![]() ,
,![]() 价的硫被氧化成
价的硫被氧化成![]() 价的硫,
价的硫,![]() ,失去
,失去![]() ,
,![]() ,得到
,得到![]() ,最小公倍数为14,根据得失电子守恒、原子守恒和电荷守恒,离子反应方程式为:
,最小公倍数为14,根据得失电子守恒、原子守恒和电荷守恒,离子反应方程式为:![]() ,故B正确;
,故B正确;
C.![]() 能和硫酸反应生成硫酸铵和二氧化碳,同时能调节溶液的pH,使
能和硫酸反应生成硫酸铵和二氧化碳,同时能调节溶液的pH,使![]() 全部转化为
全部转化为![]() ,过滤得碳酸亚铁,滤液中有硫酸铵,所以检验
,过滤得碳酸亚铁,滤液中有硫酸铵,所以检验![]() 是否洗净,就是检验洗涤滤液中是否有硫酸根离子,所以操作为取最后一次洗涤滤液,滴加盐酸酸化排除碳酸根离子的干扰,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净,故C正确;
是否洗净,就是检验洗涤滤液中是否有硫酸根离子,所以操作为取最后一次洗涤滤液,滴加盐酸酸化排除碳酸根离子的干扰,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净,故C正确;
D.煅烧时空气中的氧气作氧化剂,用氯气代替空气会生成氯化铁,不能得到高纯氧化铁,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.碱性锌锰干电池的负极反应式为:MnO2+2H2O-2e=Mn(OH)2+2OH
B.铅蓄电池放电时,正极反应式为PbO2+4H++SO42+2e=PbSO4+2H2O
C.NaHS水解反应方程式:HS+H2O ![]() H3O++S2
H3O++S2
D.过量的SO2通入到漂白粉溶液中,反应方程式:ClO+SO2+H2O=HClO+HSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的个数有( )
①氧原子的电子排布图:![]() 最外层违背了泡利原理
最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于2
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
A.0个B.1个C.2个D.3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸与醋酸钠组成的缓冲溶液对酸碱有一定的缓冲作用,缓冲能力与组分的浓度有关。室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1 mol·L1 CH3COOH溶液:c(CH3COOH)> c(CH3COO-) > c(H+)>c(OH-)
B.pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C.0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D.0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质和用途说法正确的是( )
A.明矾可作净水剂,其净水原理是利用其水解生成的氢氧化铝胶体具有吸附性
B.我国预计2020年发射首颗火星探测器其携带的太阳能电池帆板的材料是二氧化硅
C.中国高铁走向世界其车厢采用的是铝合金,主要是因为铝常温下不与氧气反应
D.CO、![]() 、NO、
、NO、![]() 在空气中都能较长时间存在,易造成大气污染
在空气中都能较长时间存在,易造成大气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 0.1 mol/L Na2SO3溶液,正确的是( )
A.升高温度,溶液 pH 降低
B.c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO![]() )+2c(HSO
)+2c(HSO![]() )+c(OH-)
)+c(OH-)
D.加入少量 NaOH 固体,c(SO![]() )与c(Na+)均增大
)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知次氯酸是比碳酸还弱的酸,反应Cl2 + H2O![]() HCl + HClO达平衡后,要使HClO浓度增大,可加入
HCl + HClO达平衡后,要使HClO浓度增大,可加入
A.足量6mol/L NaOH溶液 B.少量6mol/L H2SO4溶液
C.少量NaHCO3固体 D.足量Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,说明该反应的△H<0
B. 加水稀释0.1mol·L-1的CH3COONa溶液后,溶液中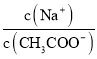 的值增大
的值增大
C. 氟元素的非金属性强于溴元素,由此可推出酸性:HF>HBr
D. 用等物质的量浓度的NaOH溶液中和等体积且pH均为2的盐酸和醋酸溶液,盐酸消耗的NaOH溶液体积更多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com