
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
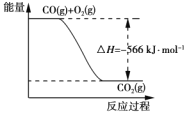
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
【答案】C
【解析】A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1,一氧化碳的燃烧热为283kJ·mol-1,故A错误;B、由热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1,可知图象中一氧化碳和氧气物质的量为1、1/2,物质的量不符合反应物质的物质的量,故B错误;C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值,由2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ·mol-1,所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-532 kJ·mol-1,故C正确;D、已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1;②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)△H=-226kJ·mol-1
依据盖斯定律②×2+①得到:2Na2O2(s)+2CO(g)=2Na2CO3(s)△H=-1018kJ·mol-1;即Na2O2(s)+CO(g)=Na2CO3(s)△H=-509kJ·mol-1;CO(g)与Na2O2(s)反应放出1/2×509 kJ=254.5kJ热量时,反应的一氧化碳物质的量为0.5mol,电子转移数为6.02×1023,故D错误;故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:
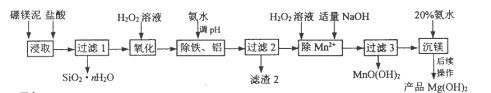
己知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;
过滤3所得滤渣中含有MnO(OH)2和__________。
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。
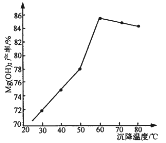
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C11H12O4的芳香族化合物A、B互为同分异构体,A和D都能发生银镜反应,E的一溴取代物同分异构体有两种,A经①②两步反应得C、D和E。B经①②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。
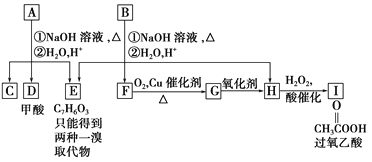
(1)A有2种可能结构,写出其结构简式:______________________________________。
(2)在B、C、D、F、G、I化合物中,互为同系物的是________。
(3)写出D与F在加热和浓H2SO4催化作用下发生反应的化学方程式:________________________,指出反应类型:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向沸水中滴加几滴饱和氯化铁溶液并继续煮沸至溶液呈红褐色时停止加热,此时当光束通过该红褐色液体时,从侧面可观察到一条光亮的“通路”说明该红褐色液体是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种血小板聚集抑制剂,其一条合成路线如下(部分试剂及反应条件省略):

已知:![]()
完成下列填空:
(1)写出反应所需试剂与条件。①________________③________________
(2)写出反应类型。②_________________④________________
(3)写出D的结构简式。___________________
(4)写出一种符合下列要求的C的同分异构体的结构简式。___________________
i.能发生银镜反应
ii.不存在-O-O-结构
iii. 苯环上只有两个处于对位的含氧取代基
(5)设计一条从A的相邻同系物合成聚苯乙烯的合成路线。___________________
(合成路线常用的表示方式为:![]() )
)
(6)根据反应⑤中反应物的相对用量与反应位置可以得出的结论是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
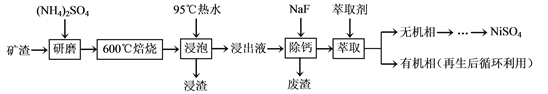
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
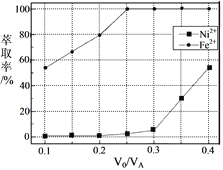
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com