
| A. | 铁粉加入到稀硫酸溶液中:Fe+2H+=Fe3++H2↑ | |
| B. | 氢氧化钠溶液吸收氯气:Cl2+2OH-=H2O+ClO-+Cl- | |
| C. | 稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++SO42-═BaSO4↓ | |
| D. | 氯化铁溶液中加入铁粉:Fe+Fe3+═2Fe2+ |
分析 A.铁与稀硫酸反应生成的是硫酸亚铁,不是生成铁离子;
B.氢氧化钠溶液与氯气反应生成氯化钠、次氯酸钠和水;
C.稀硫酸与氢氧化钡反应生成硫酸钡沉淀和水,漏掉了生成水的反应;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.铁粉加入到稀硫酸溶液中,反应生成硫酸亚铁和氢气,正确的离子方程为:Fe+2H+=Fe2++H2↑,故A错误;
B.氢氧化钠溶液吸收氯气,反应生成次氯酸钠、氯化钠和水,反应的离子方程式为:Cl2+2OH-=H2O+ClO-+Cl-,故B正确;
C.硫酸溶液与氢氧化钡溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-═2H20+BaSO4↓,故C错误;
D.氯化铁溶液中加入铁粉,反应生成氯化亚铁,正确的离子方程式为:Fe+2Fe3+═3Fe2+,故D错误;
故选B.
点评 本题考查了离子方程式的书写,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握判断离子方程式正误常用方法,如:是否满足电荷守恒、质量守恒,是否符合原反应方程式等,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:多选题
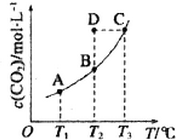 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是 ( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 | |
| B. | 在T2时,若反应处于状态D,则一定有υ正>υ逆 | |
| C. | 平衡状态A 与C 相-比,平衡状态A 的c(CO)大 | |
| D. | 若T1、T2 时的平衡常数分别为K1、K2则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2,N2,SO2 | B. | H2,N2,O2 | C. | HCl,NO2,NH3 | D. | O2,NO2,NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属的单质中,锂的还原性最强 | |
| B. | 第IA族元素比第IIA族元素的金属性强 | |
| C. | 同周期中,原子半径随原子序数的增大而减小(稀有气体除外) | |
| D. | 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2HPO3溶液显碱性,说明HPO32-的电离程度大于水解程度 | |
| B. | 25℃时,将0.1 mol•L-1的亚磷酸溶液加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| C. | 利用H3PO3进行化学镀银,当参加反应的$\frac{n(A{g}^{+})}{n({H}_{3}P{O}_{3})}$=2时,氧化产物为H3PO4 | |
| D. | NaH2PO3溶液显酸性,其溶液中存在的粒子浓度关系:c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
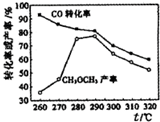 研究者在某条件下探究制备二甲醚反应:2CO(g)+4H2(g)?CH3 OCH3(g)+H2 O(g)△H,测定结果如图所示.下列判断错误的是( )
研究者在某条件下探究制备二甲醚反应:2CO(g)+4H2(g)?CH3 OCH3(g)+H2 O(g)△H,测定结果如图所示.下列判断错误的是( )| A. | △H<0 | |
| B. | 该反应伴随有副反应的发生 | |
| C. | 制备二甲醚的适宜温度为280~290℃ | |
| D. | 加入催化剂可以提高CH3 OCH3的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M>N | B. | M=10-4N | C. | N=10-4M | D. | M=N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com