
 以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池 d.废报纸 e.尼龙绳 f.轮胎 g.铁锅
以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池 d.废报纸 e.尼龙绳 f.轮胎 g.铁锅分析 a.玻璃杯的主要成分为硅酸盐,属于无机非金属材料;
b.电源插座主要成分为酚醛树脂,属于塑料;
c.废旧干电池中含有重金属元素汞等,有毒,随意丢弃能够污染水和土壤;
d.废报纸主要成分为纤维素,可循环利用;
e.尼龙绳主要成分为合成纤维,属于高分子材料;
f.轮胎主要成分为橡胶,属于合成高分子材料;
g.铁锅主要成分为铁,属于金属材料,可回收利用.
解答 解:①a.玻璃杯主要成分为硅酸盐,属于无机非金属材料;
故选:a;
②轮胎主要成分为橡胶,属于合成高分子材料;
故选:f;
③废旧干电池中含有重金属元素汞等,有毒,随意丢弃能够污染水和土壤;
故选:c;
④废报纸主要成分为纤维素,可循环利用;
故选:A.
点评 本题考查了生活中常见的材料及其分类,熟悉材料的成分是解题关键,注意废旧材料的处理方法.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
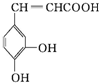
| A. | 该物质中苯环上一氯代物有2种 | |
| B. | 该分子结构中含有两种官能团 | |
| C. | 既能发生取代反应,也能发生加成反应 | |
| D. | 所有碳原子不可能都在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
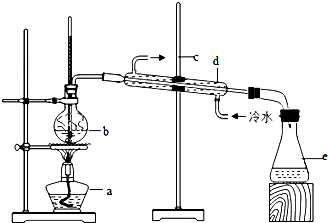
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com