
把1 mL 0.1 mol·L-1的H2SO4加水稀释制成2 L溶液,在此溶液中由水电离产生的H+的浓度接近于( )
A.1×10-4 mol·L-1 B.1×10-8 mol·L-1
C.1×10-11 mol·L-1 D.1×10-10 mol·L-1
科目:高中化学 来源: 题型:
已知A是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
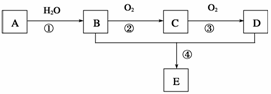
请回答下列问题:
(1)写出A的结构简式________________。
(2)B、D分子中的官能团名称分别是__________、______________。
(3)物质B可以被直接氧化为D,需要加入的试剂是
________________________________________________________________________。
(4)写出下列反应的化学方程式:
①________________________________________________________________________;
反应类型:____________。
④________________________________________________________________________。
反应类型:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定容积的密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)2C(g) ΔH<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合右图中曲线的是 ( )。
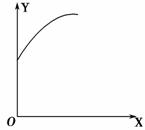
| X | Y | |
| A | 再加入A | B的转化率 |
| B | 加入催化剂 | A的体积分数 |
| C | 充入氦气 | A的转化率 |
| D | 升高温度 | C的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
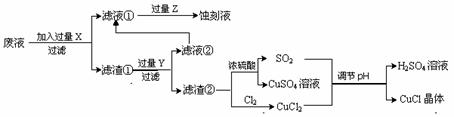
|
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是_____________________。
(2)写出生产过程中X:____ ______ Y:_____ _____ (填化学式)。
(3)写出产生CuCl的化学方程式:_________________________________________。
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是:______________________________。
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
________________________________ _____。
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 ══CuCl2 + FeCl2 Fe2+ + Ce4+ ══ Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
查看答案和解析>>
科目:高中化学 来源: 题型:
右图所示的试管中盛有较浓的氨水,氨水中因加有酚酞而显浅红色。
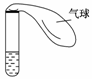
(1)对试管以热水浴的方式加热,观察试管中的溶液,结果是____________(有现象就写明现象的内容,无现象就写明无现象的原因)。
(2)把加热后的试管放入约20℃的水中冷却,观察试管中的溶液里是否有明显的现象,它是________________________________________________________________________
(有现象就写明现象的内容,无现象就写明无现象的原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为
A. 1:3 B.2:3 C.3:2 D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
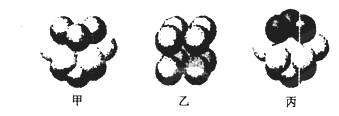
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色
B.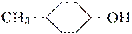 的消去产物有两种
的消去产物有两种
C.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2===CH—COOCH3
D.可用溴水鉴别乙醛、四氯化碳、苯和乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com