
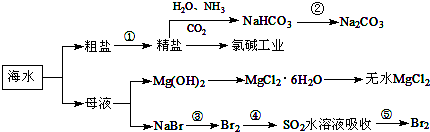
| A. | 要实现反应②可向NaHCO3溶液中加入过量石灰水 | |
| B. | 氯碱工业中采用阴离子交换膜提高产品纯度 | |
| C. | MgCl2溶液加热蒸干可得无水MgCl2 | |
| D. | 溴元素在反应③、⑤中均被氧化,在反应④中被还原 |
分析 A.要实现反应②可向NaHCO3溶液中加入过量石灰水,NaHCO3和Na2CO3都与澄清石灰水反应生成沉淀;
B.氯碱工业是电解饱和食盐水,溶液中阳极上氢离子和阴极上氯离子放电,在阴极产生氢氧化钠,为防止氯气与氢氧化钠反应采用阳离子交换膜,使钠离子转移到阴极,所以提高产品纯度;
C.MgCl2溶液加热,镁离子水解生成氢氧化镁和氯化氢,氯化氢易挥发,使水解可以完全;
D.根据物质的性质及变化结合元素化合价的变化判断.
解答 解:A.要实现反应②可向NaHCO3溶液中加入过量石灰水,NaHCO3和Na2CO3都与澄清石灰水反应生成沉淀,不能得到碳酸钠,可以加热分解得到,故A错误;
B.氯碱工业是电解饱和食盐水,溶液中阳极上氢离子和阴极上氯离子放电,在阴极产生氢氧化钠,为防止氯气与氢氧化钠反应采用阳离子交换膜,使钠离子转移到阴极,所以提高产品纯度,故B错误;
C.MgCl2溶液加热,镁离子水解生成氢氧化镁和氯化氢,氯化氢易挥发,使水解可以完全,故C错误;
D.海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,④中溴得电子化合价降低,所以溴元素被还原,故D正确;
故选D.
点评 本题重点考查了化学与资源综合利用、环境保护等方面的知识,开发利用金属矿物和海水资源是新课程标准教材中的必修内容,在高考命题上也有所体现.海水资源相关的海水提溴、海水提镁都是高考命题的热点,同学们应给予重视.只在掌握好相关的物理、化学性质以及基本实验技能就能顺利解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Fe3+、NH4+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸 NaCl+MnO2 AgNO3 | B. | NaOH溶液 Ca(HCO3)2 Ca(OH)2 | ||
| C. | NaOH溶液 (NH4)2SO4 KAl(SO4)2 | D. | 浓硫酸 NaCl H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
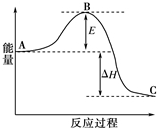 合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示0.001 mol•L一1盐酸滴定0.001 mol•L一1NaOH溶液的滴定曲线 | |
| B. | 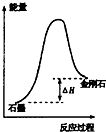 所示,石墨的熔点比金刚石低 | |
| C. | 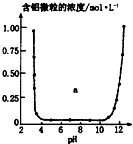 表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3 | |
| D. | 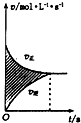 所示,图中的阴影部分面积的含义是[v(正)-v(逆))] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水导电能力比BaSO4的水溶液强,所以氨水是强电解质,BaSO4是弱电解质 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 若反应C(s)+CO2(g)?2CO(g)在常温下不能自发,则该反应的△H>0 | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
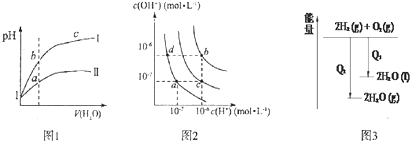
| A. | 图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 图3表示氢气与氧气反应中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Fe2+ | Cl- | SO42- |
| 浓度(mol/L) | 3.0×10-4 | 2.0×10-4 | 2.5×10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com