
有一块铁的“氧化物”样品,用140mL 5.0mol·L-1 盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
D
【解析】
试题解析:n (HCl)=0.14L×5.0mol/L=0.7mol,由氧化物和盐酸反应生成水可知,氧化物中含有n(O)= n(HCl)=0.35mol,
n(HCl)=0.35mol,
所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,反应后所得溶液为FeCl3,因n(Cl-)=0.7mol+0.025mol×2=0.75mol,则n(Fe3+)=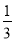 n(Cl-)=0.25mol,所以氧化物中n(Fe):n(O)=0.25:0.35=5:7,
n(Cl-)=0.25mol,所以氧化物中n(Fe):n(O)=0.25:0.35=5:7,
所以化学式为Fe5O7,选D.


科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故需加NaOH固体才能恢复到原溶液
C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
D.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期半期联考化学试卷(解析版) 题型:选择题
已知1L 0.1 mol/L的NaRO3溶液中含RO3-的质量为8.5克。在RO3-中,氧原子中质子数和中子数相等,R的中子数为20,则RO3-的核外电子总数为
A.40 B.42 C.44 D.46
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期半期联考化学试卷(解析版) 题型:选择题
下列反应中,属于氧化还原反应,但不属于四种基本反应类型的是
A.CaO+H2O=== Ca(OH)2
B.Zn+2HCl=== ZnCl2+H2↑
C.2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
D.NaCl+AgNO3===AgCl↓+NaNO3
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:填空题
(12分)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。

回答下列问题:
(1)A的电子式为______________。
(2)A和E反应生成G,C与G中都含有_______________(填化学键的类型)。 (3)反应③中如果转移的电子为3 mol,则被氧化的A为__________mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:_____________________________________________________。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO4-形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
下列实验设计方法正确的是( )
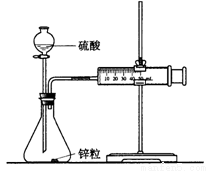
A.向卤代烃加硝酸酸化的硝酸银来检验其中的卤族素元素
B.实验用NH4Cl固体受热分解来制备NH3
C.用盐酸和澄清石灰水来检验某物质是否含有CO32-
D.可用下图所示的装置和药品来研究反应物浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
下列实验中,所采取的分离方法与对应原理都正确的是 ( )
选项 | 目的 | 分离方法 | 原理 |
A. | 分离氢氧化铁胶体和氯离子 | 盐析 | 胶体不能透过半透膜,离子能 |
B. | 分离植物油和水的混合物 | 分液 | 二者互不相溶且密度不同 |
C. | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
D. | 除去乙醇中的乙酸 | 蒸馏 | 乙醇与乙酸沸点相差较大 |
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三上学期第二次检测考试化学试卷(解析版) 题型:实验题
(16分)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
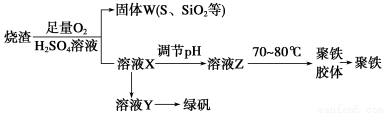
(1)验证固体W焙烧后产生的气体含有SO2的方法是 ________________。
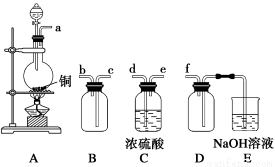
(2)实验室制备、收集干燥的SO2,所需仪器如下图。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。装置A中发生反应的化学方程式为___________________。
(3)制备绿矾时,向溶液X中加入过量________,充分反应后, 经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。 过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三第一次联考化学试卷(解析版) 题型:选择题
下列有关物质性质的描述和该性质的应用均正确的是( )
A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com