
| A. | 还原性强弱:F-<Cl-<I- | B. | 半径K+>Mg2+>Al3+>H+ | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
分析 A、非金属性越强,对应离子的还原性越弱;
B、电子层数越多半径越大,电子层数相同时,核电荷数越多半径越小;
C、非金属性越强,气态氢化物越稳定;
D、金属性越强,对应最高价氧化物的水化物的碱性越强.
解答 解:A、非金属性越强,对应离子的还原性越弱,非金属性F>Cl>I,对应离子的还原性为F-<Cl-<I-,故A正确;
B、K+三个电子层,Mg2+和Al3+两个电子层,铝离子的核电荷数多,H+的半径最小,所以半径K+>Mg2+>Al3+>H+,故B正确;
C、非金属性Cl>S>P,气态氢化物的稳定性为PH3<H2S<HCl,故C错误;
D、金属性Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故D正确.
故选C.
点评 本题考查元素周期律,熟悉元素在周期表中的位置及元素周期律是解答本题的关键,难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应中一定有新物质生成 | |
| B. | 化学反应中旧的化学键的断裂需要吸收热量,新的化学键的生成需要放出能量 | |
| C. | 化学反应通常需要加热等条件才能发生 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气中发生的催化转化反应:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 | |
| B. | 工业制氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO32-═CaCO3+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝与氨水反应:Al3++3 OH-═Al(OH)3↓ | |
| B. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| C. | 饱和NH4Cl溶液中加入NaOH浓溶液:NH4++OH-═NH3↑+H2O | |
| D. | 氯气通入FeCl2溶液中:2Fe2++Cl2═2 Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | Ba(OH)2 | C. | KSCN | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个反应都是氧化还原反应 | |
| B. | 两个反应都是置换反应 | |
| C. | 两个反应都有化学能与热能之间的转化 | |
| D. | 反应(2)是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
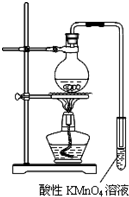 某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | $\frac{m}{n}$ | 固体成分 | 排出气体物质成分 |
| ① | <$\frac{1}{2}$ | Na2CO3 | |
| ② | =$\frac{1}{2}$ | Na2CO3 | O2、H2O |
| ③ | $\frac{1}{2}$<$\frac{m}{n}$<1 | ||
| ④ | =1 | ||
| ⑤ | >1 | Na2CO3、NaOH、Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自来水生成流程示意图
自来水生成流程示意图查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com