
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
科目:高中化学 来源: 题型:多选题
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
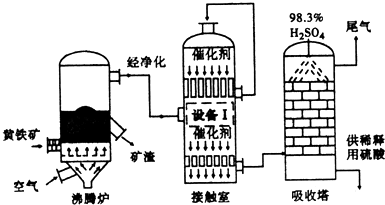
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
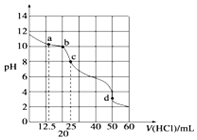 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO-3)>c(OH-) | B. | b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) | D. | d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
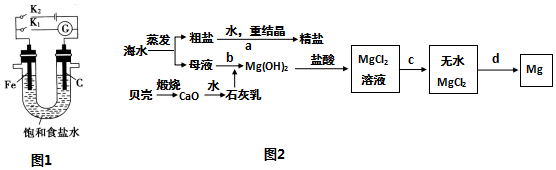
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com