
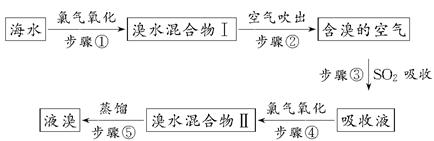


科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 344 mL | B.672 mL | C.大于1 344 mL | D.小于672 mL |
查看答案和解析>>
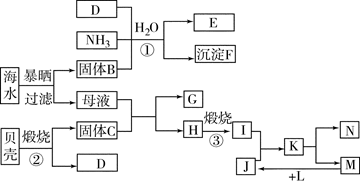
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
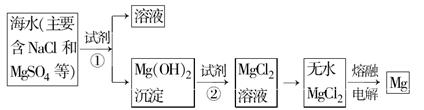
科目:高中化学 来源:不详 题型:单选题
| A.镁元素在元素周期表中位于第3周期,ⅡA族 |
| B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 |
| C.在氯化氢热气流中干燥晶体的目的是抑制MgCl2水解 |
| D.步骤⑤也可以采用电解该晶体水溶液的方法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸遇明火爆炸 |
| B.浓硫酸遇水发热爆炸 |
| C.铁与水(常温下)反应产生的氧化物爆炸 |
| D.稀释后的硫酸与铁反应产生的氢气在空气中遇明火而爆炸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化铝陶瓷 | B.氮化硅陶瓷 |
| C.光导纤维 | D.玻璃钢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com