

分析 甲烷碱性燃料电池中正极氧气得电子被还原,反应式为:2O2+4H2O+8e-═8OH-,负极甲烷失电子被氧化,反应式为:CH4-8e-+10OH-═CO32-+7H2O,则与正极氧气相连的a极为阳极,氯离子放电生成氯气,反应式为:2Cl--2e-=Cl2↑,与负极甲烷相连的b极为阴极,H+放电,生成H2,反应式为:2H++2e-=H2↑,结合关系式1 mol CH4~8 mol e-~4 mol Cl2分析计算.
解答 解:(1)根据以上分析,与正极氧气相连的a极为阳极,与负极甲烷相连的b极为阴极,H+放电,生成H2,反应式为:2H++2e-=H2↑,所以b电极附近溶液的pH增大,故答案为:阳极;增大;
(2)甲烷碱性燃料电池中正极氧气得电子被还原,反应式为:2O2+4H2O+8e-═8OH-,故答案为:2O2+4H2O+8e-═8OH-;
(3)与负极甲烷相连的b极为阴极,H+放电,生成H2,反应式为:2H++2e-=H2↑,根据得失电子守恒,可得:1 mol CH4~8 mol e-~4 mol Cl2,故若反应生成0.2mol Cl2,则消耗CH4的物质的量为0.05 mol,故答案为:2H++2e-=H2↑;0.05 mol.
点评 本题涵盖电解池和原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
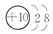 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
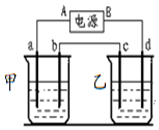 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
科目:高中化学 来源: 题型:实验题
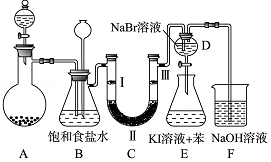 如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略). MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH试纸使用之前需用蒸馏水润湿 | |
| B. | 用广泛pH试纸测定某溶液的pH为3.5 | |
| C. | pH=7的溶液一定呈中性 | |
| D. | 中性溶液的c(H+)=$\sqrt{K_W}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com