




科目:高中化学 来源:不详 题型:单选题

| A.该电池工作时电能转化为化学能 |
| B.通入氢气的一极是负极 |
| C.外电路中电子由电极b通过导线流向电极a |
| D.该电池的总反应:2H2+O2=2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
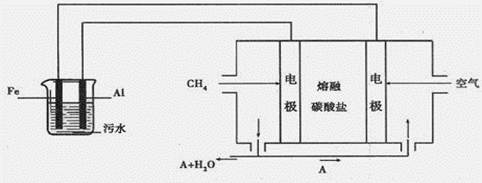
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该电池的正极反应式:H2O2+2H++2e—=2H2O |
| B.燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C.电池工作时,1 mol甲醇被氧化有6 mol电子转移 |
| D.电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该装置将化学能转变为电能 | B.溶液中的阳离子向锌电极移动 |
| C.Cu极上有气泡产生,发生还原反应 | D.电流方向是从铜片流向锌片 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.碱性锌锰电池中,MnO2是催化剂 | B.银锌纽扣电池工作时,Ag2O被还原为Ag |
| C.放电时,铅酸蓄电池中硫酸浓度不断增大 | D.电镀时,待镀的金属制品表面发生还原反应 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 两极材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | 硫酸溶液 | 硝酸银溶液 | 蔗糖溶液 | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
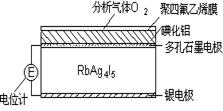
| A.Ag-e-=Ag+ | B.I2+2Ag++2e-=2AgI |
| C.I2+2Rb++2e-=2RbI | D.4AlI3+3O2=2Al2O3+6I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.①②中Mg作负极,③④中Fe作负极 |
| B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ |
| C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+ |
| D.④中Cu作正极,电极反应式为2H++2e-=H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com