
����Ŀ�������������(��������)�е��麬���Ƿ꣬ʵ��װ������ͼ��ʾ(�г�װ������ȥ)��
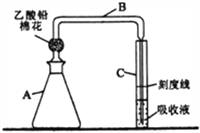
��ʵ��1�����������Һ
��ȡ0.132gAg2O3����NaOH��Һ��ȫ�ܽ�����Ƴ�1LNa3AsO3��Һ������Һ1mL�൱��0.10mg�飩��
��ȡһ����������Һ������1L������Ϊ1mg��L-1�������Һ��
��1��������У�����ʹ�õIJ����������ձ����������⣬����__________���������ȡ�ò������Na3AsO3��Һ____mL��
��ʵ��2���Ʊ��������Һ
����Aƿ�м���2.00mL�����Һ�������μ���һ���������ᡢKI��Һ��SnCl2��Һ�����ȣ����·���10 min��ʹ��Ԫ��ȫ��ת��ΪH3AsO3��
����Aƿ�м�������п��(����ZnS����)����������װ������Ǧ���ĵ�����B����ʹB���Ҳ�ĩ�˲����ɫ��C����������Һ��Һ���£����Ʒ�Ӧ�¶�25~40����45 min�����ɵ��黯�����屻��ȫ���գ�Ag+����ԭΪ��ɫ��̬����
��ȡ��C�ܣ������������ȷ����̶��ߣ����ȣ��õ��������Һ��
��2������Ǧ����������_____________________��
��3����������黯�ⷴӦ�����ӷ���ʽ��
____Zn+____H3AsO3+____H+=____( )+ ____Zn2++____( )________________
��4������A ƿ�з�Ӧ�¶ȵķ�����________________________����Ӧ�У�Aƿ�н϶������������������˽��������⣬�����е�������_____________________________��
��5��B���Ҳ�ĩ�˵��ܿھ����ܹ���(ԼΪ1mm)��ԭ����__________________________��
��ʵ��3���ж���Ʒ���麬���Ƿ�
��ȡag������Ʒ�����ʵ��2�� ���С�2.00m�����Һ�����ظ���ʵ��2��������������ʵ������Һ�����������Һ�ȶԣ�������Һ�����ɫdz��˵������Ʒ������δ���꣬��֮�ꡣ
��6������涨������Ϊ�����֮��(��������)����a��ֵΪ______________________��
���𰸡� 1000mL����ƿ����ͷ�ι� 10.0 ��ȥH2S���� 3Zn+H3AsO3+6H+=AsH3��+3Zn2++3H2O ˮԡ���� ��AsH3������ȫ����C�ܣ������������𰸣� ����Ӧ�Ӵ������ʹAsH3���屻������գ�ȷ���γɽ�̬�� 1.0
����������1��������У�����ʹ�õIJ����������ձ����������⣬����1000mL����ƿ����ͷ�ιܣ�1mL�൱��0.10mg�飬����1L������Ϊ1mg��L-1�������Һ���������ȡ�ò������Na3AsO3��Һ 10.0mL����2��H2S��CH3COO2Pb=PbS����2CH3COOH,����Ǧ���������dz�ȥH2S���壻��3��п��+3�۵��黹ԭ�����黯�⣬�Ȼ�п��ˮ����Ӧ�����ӷ���ʽ3Zn+H3AsO3+6H+=AsH3��+3Zn2++3H2O����4�����Ʒ�Ӧ�¶�25~40�����ɲ���ˮԡ��������Ӧ�У�Aƿ�н϶������������������˽��������⣬����û������װ�ã��ɼ�����һ�����þ��������������е������ǽ�AsH3������ȫ����C�ܣ������������𰸣�����5��B���Ҳ�ĩ�˵��ܿھ����ܹ���(ԼΪ1mm)��ԭ��������Ӧ�Ӵ������ʹAsH3���屻������գ�ȷ���γɽ�̬������6������涨������Ϊ�����֮��(��������)��a��2��10-6=2��10-3L��1��10-6��g��L-1����a=1.0,��a��ֵΪ1.0��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�����������ȷ����

A. ��AΪH2O2��BΪMnO2��C��ʢ��Na2S��Һ�� C����Һ�����
B. ��AΪŨ���ᣬBΪMnO2��C��ʢ��KI������Һ��C����Һ����ɫ
C. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢ��AlCl 3��Һ�� C���Ȳ�����ɫ������������ܽ�
D. ��AΪŨH2SO4 ��BΪCaCO3��C��ʢ��Na2SiO3 ��Һ��C����Һ���ְ�ɫ������֤���ǽ�����S��C��Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��120 mL����0.20 mol̼���Ƶ���Һ��200 mL���ᣬ���ܽ�ǰ�ߵμ�����ߣ����ǽ����ߵμ���ǰ�ߣ�����������������������ɵ����������ͬ���������Ũ�Ⱥ�������( )
A. 2.0 mol��L-1 B. 1.5 mol��L-1 C. 0.18 mol��L-1 D. 0.24 mol��L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��������Na2O���ʵ�Na2O2���������ⶨNa2O2�����Ĵ��ȡ��ɹ�ѡ�õķ�Ӧ��ֻ��CaCO3���塢6mol��L��1���ᡢ6mol��L��1���������ˮ����֪����Ũ��������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��ڼ�ʯ�ҵijɷ�ΪCaO��NaOH��ʵ�鷽��Ϊ�����Ʊ����ᴿCO2���ڽ�������CO2ͨ���������۲ⶨ����O2��������ܸ���O2���������Na2O2�����Ĵ��ȡ�ʵ��װ�����£�

�ش��������⣺
��1��װ��A�з�����Ӧ�����ӷ���ʽ��______________________________________��
��2��װ��B��������_______________________��װ��C��������_______��
��3��װ��E��������__________________________________________
��4��װ��D�з�����Ӧ�Ļ�ѧ����ʽ��______________________________________��
��5������ʼʱ�����Ʒ������Ϊ2.0g����Ӧ���������������Ϊ224mL(��״��)����Na2O2�����Ĵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬TΪ������ʹ����㷺�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ������

��1������A�Ļ�ѧʽΪ ________��
��2��H�ڳ�ʪ�����б��M��ʵ��������______________________________________����ѧ����ʽΪ___________________________________________��
��3��A��ˮ��Ӧ����B��C�����ӷ���ʽΪ___________________________________���ɴ˷�Ӧ��֪A����Ϊ_________����;��
��4������ٵ����ӷ���ʽ_______________________________________����д�����鲽��ٵõ�����Һ����Ҫ�����ӣ���H+�⣩����Ҫ���Լ���_____________��____________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ˮ�ĵ����Ϊa1��pH=2�Ĵ�����Һ�ĵ����Ϊa2��pH=12������������Һ��ˮ�ĵ����Ϊa3��������������������������Һ�������ϣ�������Һ��ˮ�ĵ����Ϊa4�����й�ϵʽ����ȷ����
A. a3=a2��a1��a4 B. a2=a3��a4��a1
C. a2��a3��a1��a4 D. a1��a2��a3��a4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к���X����Y2����Z2�����ֳ����������ӡ�����ͼ��ʾ��������һϵ�л�ѧ��Ӧ���ڢܲ���Ӧ���ɵİ�ɫ�����к�Y2��.

��1���ж�X����Y2����Z2���ֱ�Ϊ________��________��________��д���ӷ��ţ���
��2��д���ܡ��ݲ���Ӧ�����ӷ���ʽ��
��______________________________________________________��
��______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017���ҹ��״κ����ȼ��(����Ľᾧˮ����)�Բɳɹ������ڼ���Ľṹ������˵����ȷ����( )
A.��ƽ�������η���B.����ǿ�ᡢǿ�Ӧ
C.���������ڹ��������·�ӦD.��ʹ�������������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ͭпԭ��أ�ϡ�������������Һ��������������ǣ� ��
A.����������ͨ����������
B.������ӦʽΪ��Zn��2e��=Zn2+
C.��������1molH2���ת��2mol����
D.������̼������ͭƬ��Ϊ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com