
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
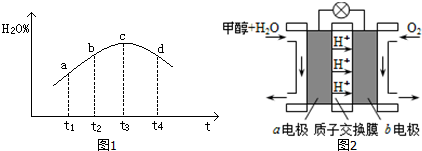
分析 (1)根据方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每转移12mol电子,放出1591.2kJ热量,据此计算;
(2)①根据v=$\frac{△c}{△t}$计算v(H2),再根据速率之比等于化学计量数之比计算v(CO2);
②a.恒容条件下,反应物和产物都是气体,密度始终不变;
b.容器内CO、H2O、CO2、H2的浓度不再变化,则说明反应处于平衡状态;
c.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变;
d.该反应气体的物质的量不变,气体的质量也不变,所以反应过程中气体的平均相对分子质量不变;
e.v正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等;
③c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行;
(3)通甲醇(CH3OH)的一极为负极,电极的电池工作时负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
解答 解:(1)根据方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每转移12mol电子,放出1591.2kJ热量,所以每转移1mole-,可放出的热量为132.6kJ,
故答案为:132.6kJ;
(2)①v(H2)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L.min),速率之比等于化学计量数之比,则v(CO2)=v(H2)=0.15mol/(L.min),
故答案为:0.15mol/(L.min);
②a.恒容条件下,反应物和产物都是气体,密度始终不变,故错误;
b.容器内CO、H2O、CO2、H2的浓度不再变化,则说明反应处于平衡状态,故正确;
c.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变,故错误;
d.该反应气体的物质的量不变,气体的质量也不变,所以反应过程中气体的平均相对分子质量不变,故错误;
e.v正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等,故正确;
故选:be;
③c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等,故b点υ正>υ逆;
故答案为:>;
(3)通甲醇(CH3OH)的一极为负极,电极的电池工作时负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+,故答案为CH3OH-6e-+H2O=CO2+6H+.
点评 本题考查的知识点较多,既考查了电化学又考查了反应热的问题,对学生综合运用知识能力有一定的要求,特别是根据图中信息写电极反应,要求学生有较好从图中获取信息的能力,整个题目难度较大.


科目:高中化学 来源: 题型:解答题
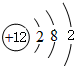 、
、 ,C的离子结构示意图
,C的离子结构示意图
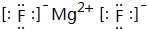 化学键类型为离子键.
化学键类型为离子键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和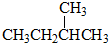
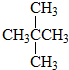 和
和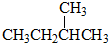
| 类别 | 同位素 | 同素异形体 | 同系物 | 同分异构体 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
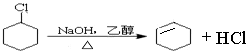
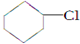 (一氯环己烷)$→_{△②}^{NaOH、乙醇}$
(一氯环己烷)$→_{△②}^{NaOH、乙醇}$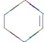 $→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$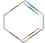
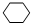 ,名称是环己烷.
,名称是环己烷.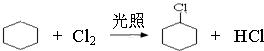 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+Cu2++H2O═4 Na++Cu(OH)2↓+O2↑ | |
| B. | 工业上用石灰乳制备漂白粉:Ca+2OH-+Cl2=Ca2++ClO-+Cl-+H2O | |
| C. | 向Na2SiO3溶液中通入过量SO2:SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3- | |
| D. | 制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{83}^{209}$Bi比${\;}_{83}^{210}$Bi的质量数小1 | |
| B. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi都含有83个中子 | |
| C. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi的核外电子数不同 | |
| D. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi分别含有126和127个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
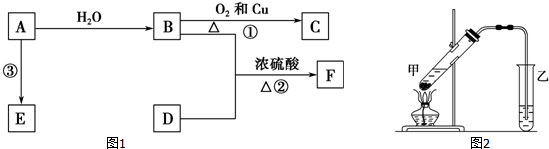
 ,B的官能团名称为羟基.
,B的官能团名称为羟基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com