
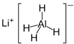
 )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)液氨类似于水的电离,试写出液氨的电离方程式 ;
(3)下列离子方程式书写正确的是 。 ?
A.石灰乳与Na2CO3溶液混合:Ca2++CO32—=====CaCO3↓?
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4+ + HSO3- +2OH-![]() NH3↑+SO32- +2H2O?
NH3↑+SO32- +2H2O?
C.酸性条件下KIO3溶液与KI溶液反应生成I2: IO32- +5I-+3H2O====3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=====AgOH↓+NH4+
E.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===== BaSO4↓+H2O?
F.CuSO4溶液吸收H2S气体:Cu2++H2S======CuS↓+2H+?
G.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O ===== AlO2- +4NH 4+ +2H2O
H.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2++2OH-+NH4+ +HCO3-=== BaCO3↓+NH3·H2O+H2O
I.LiAlH4溶于适量水后得到无色溶液,则化学方程式可表示为:
LiAlH4+2H2O ===LiAlO2 +4H2↑
(4)Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。
A.3∶2∶1 B.2∶4∶1? C.2∶3∶1 D.4∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)液氨类似于水的电离,试写出液氨的电离方程式 ;
(3)下列离子方程式书写正确的是 。 ?
A.石灰乳与Na2CO3溶液混合:Ca2++CO32—=====CaCO3↓?
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4+ + HSO3- +2OH- NH3↑+SO32- +2H2O?
C.酸性条件下KIO3溶液与KI溶液反应生成I2: IO32- +5I-+3H2O====3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=====AgOH↓+NH4+
E.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===== BaSO4↓+H2O?
F.CuSO4溶液吸收H2S气体:Cu2++H2S======CuS↓+2H+?
G.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O ===== AlO2- +4NH 4+ +2H2O
H.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2++2OH-+NH4+ +HCO3-=== BaCO3↓+NH3·H2O+H2O
I.LiAlH4溶于适量水后得到无色溶液,则化学方程式可表示为:
LiAlH4+2H2O ===LiAlO2 +4H2↑
(4)Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。
A.3∶2∶1 B.2∶4∶1? C.2∶3∶1 D.4∶2∶1
查看答案和解析>>
科目:高中化学 来源:2011届浙江省杭十四中高三上学期11月月考化学卷 题型:填空题
回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)液氨类似于水的电离,试写出液氨的电离方程式 ;
(3)下列离子方程式书写正确的是 。 ?
A.石灰乳与Na2CO3溶液混合:Ca2++CO32—=====CaCO3↓?
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4+ + HSO3- +2OH-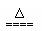 NH3↑+SO32- +2H2O?
NH3↑+SO32- +2H2O?
C.酸性条件下KIO3溶液与KI溶液反应生成I2: IO32- +5I-+3H2O====3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=====AgOH↓+NH4+
E.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-="====" BaSO4↓+H2O?
F.CuSO4溶液吸收H2S气体:Cu2++H2S======CuS↓+2H+?
G.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O ="====" AlO2- +4NH 4+ +2H2O
H.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2++2OH-+NH4+ +HCO3-="== " BaCO3↓+NH3·H2O+H2O
I.LiAlH4溶于适量水后得到无色溶液,则化学方程式可表示为:
LiAlH4+2H2O ="==LiAlO2" +4H2↑
(4) Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。
A.3∶2∶1 B.2∶4∶1? C.2∶3∶1 D.4∶2∶1
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:填空题
回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)液氨类似于水的电离,试写出液氨的电离方程式 ;
(3)下列离子方程式书写正确的是 。 ?
A.石灰乳与Na2CO3溶液混合:Ca2++CO32—=====CaCO3↓?
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4+ + HSO3- +2OH- NH3↑+SO32- +2H2O?
NH3↑+SO32- +2H2O?
C.酸性条件下KIO3溶液与KI溶液反应生成I2: IO32- +5I-+3H2O====3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=====AgOH↓+NH4+
E.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===== BaSO4↓+H2O?
F.CuSO4溶液吸收H2S气体:Cu2++H2S======CuS↓+2H+?
G.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O ===== AlO2- +4NH 4+ +2H2O
H.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2++2OH-+NH4+ +HCO3-=== BaCO3↓+NH3·H2O+H2O
I.LiAlH4溶于适量水后得到无色溶液,则化学方程式可表示为:
LiAlH4+2H2O ===LiAlO2 +4H2↑
(4)Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。
A.3∶2∶1 B.2∶4∶1? C.2∶3∶1 D.4∶2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com