
【题目】下列说法正确的是
A. 将纯水加热至较高温度,Kw变大、pH变小、呈酸性
B. 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 向0.1 mol·L-1醋酸溶液中加入少量冰醋酸,溶液的pH减小,醋酸电离程度变大
D. 等体积、pH都为3的酸HA和HB分别与足量的Zn反应,HA放出的H2多,说明HA的酸性小于HB
【答案】D
【解析】
A. 水的电离是吸热过程,将纯水加热至较高温度,促进了水的电离,氢离子和氢氧根离子浓度增大,水的离子积增大,pH减小,但电离出的氢离子和氢氧根离子浓度相等,所以水仍是中性,故A错误;
B. 常温下,将pH=4的醋酸溶液稀释后,溶液中氢离子的浓度降低,由c(OH)=![]() 可知氢氧根离子的浓度增大,故B错误;
可知氢氧根离子的浓度增大,故B错误;
C.向0.1 mol·L-1醋酸溶液中加入少量冰醋酸,醋酸的电离平衡正向移动,氢离子的浓度增大,pH减小,但醋酸的电离程度减小,故C错误;
D.等体积,pH都为3的酸HA、HB分别与足量的Zn反应,HA放出的H2多,说明HA的物质的量大于HB的物质的量,溶液的体积相等,则HA的物质的量浓度大于HB的物质的量浓度,说明HA的酸性弱于HB,故D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是
A. 在NaOH水溶液中加热,化合物X可发生消去反应
B. 在一定条件下,1mol化合物Y可消耗4molBr2
C. 用FeCl3溶液可鉴别化合物X和Y
D. 在一定条件,化合物Y可与HCHO发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A~J均为有机化合物,根据图中的信息,回答下列问题。
已知:分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生反应:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为_______________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为__________________________________。
(3)由E和A反应生成F的化学方程式为___________________________________。
(4)D中含有的官能团是________,由H生成I的反应类型是______________
(5)已知:R-COOH+NaOH→R-COONa+H2O,G的分子式为C6H10O4,0.146gG需用20mL0.100mol·L-1 NaOH溶液完全中和,G的结构简式为______________________;
(6)![]() 为重要的化工原料,根据题中信息,设计以1,3-丁二烯为原料合成
为重要的化工原料,根据题中信息,设计以1,3-丁二烯为原料合成![]() 的合成路线_____________________________(以流程图形式表示,无机试剂任选)。
的合成路线_____________________________(以流程图形式表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,试求:(1)反应消耗的氧化剂的质量;(2)被氧化的HCl的质量。
MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,试求:(1)反应消耗的氧化剂的质量;(2)被氧化的HCl的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种极其重要的化工原料,下图是石油加工的部分转化关系:
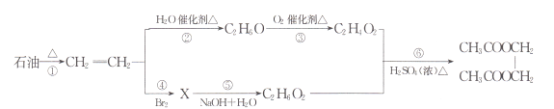
回答下列问题:
(l)石油化工生产中,通常将第①步转化的方法称为____;反应②的反应类型为____。
(2)反应③包含两步氧化反应,生成的C2H402属于酯类的同分异构体的名称为____,X的结构简式为____。
(3)一定条件下,乙烯能发生加聚反应,其化学方程式为____;反应⑥的化学方程式为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为_____________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ΔH>0,请你分析该设想能否实现并说明理由是____________________________________________。
(3)甲酸的电离平衡常数Ka=1.70×10-4。向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为______________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
(5)工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_______________________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com