
为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入答题卡中。
供选择的化学试剂:
A.酸性高锰酸钾
B.硝酸银溶液和硝酸
C.氢氧化钠溶液
D.无水硫酸铜粉末
|
实验要求 |
化学试剂 |
|
检验酒精中是否有水 |
|
|
区别CH4和C2H4两种无色气体 |
|
|
验证味精是否有食盐 |
|
|
除去Fe2O3中的Al2O3 |
|
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(8分)
(1)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分,进行以下实验:取甲溶液,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成。实验过程中所发生反应的离子方程式为: ;甲是 溶液,乙是 溶液;
(2)为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填在相应的空格中
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江省牡丹江一中高一上学期期末考试化学试卷 题型:实验题
(8分)
(1)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分,进行以下实验:取甲溶液,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成。实验过程中所发生反应的离子方程式为: ;甲是 溶液,乙是 溶液;
(2)为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填在相应的空格中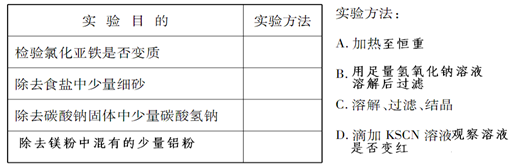
查看答案和解析>>
科目:高中化学 来源:2013-2014学年吉林省延边州高三上学期质量检测理综化学试卷(解析版) 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2
(g)  CH3OH (g) DH1
CH3OH (g) DH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH (g)+H2O(g)
DH2
CH3OH (g)+H2O(g)
DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断DH1_______________0(填“<”、“=”或“>”)。
② 某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为________________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式__________________________________。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
|
CO的初始浓度(mol/L) |
2 |
4 |
1 |
3 |
|
H2的初始浓度(mol/L) |
3 |
2 |
3 |
3 |
|
时间(min) |
8 |
6 |
12 |
n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江省高一上学期期末考试化学试卷 题型:实验题
(8分)
(1)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分,进行以下实验:取甲溶液,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成。实验过程中所发生反应的离子方程式为: ;甲是 溶液,乙是 溶液;
(2)为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填在相应的空格中
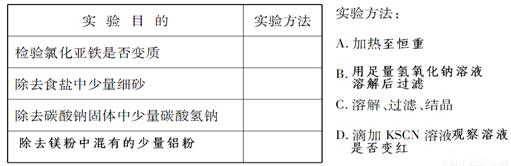
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com