
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 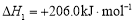
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 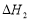
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
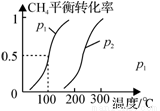
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
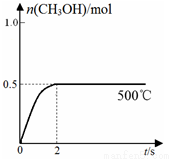
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g) 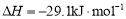 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(14分)
(1)①0.003mol·L-1min-1 (2分) ② < (1分) ③ 3:1 (2分)
(2)① 低温 (1分) ② Cu2O+CO 2Cu+CO2 (2分)
2Cu+CO2 (2分)
③  (画出达平衡时间小于2s给1分;画出平衡时纵坐标高于恒容时给1分。共2分。)
(画出达平衡时间小于2s给1分;画出平衡时纵坐标高于恒容时给1分。共2分。)
(3)①4.0×106 (2分) ②低于80℃,反应速率较小;高于80℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低(答出前者给1分;答出后者即给2分;)
【解析】
试题分析:(1)①100℃时达到平衡的时间为5min,甲烷的转化率是0.5,则甲烷的浓度减少1.0mol×0.5/100L=5×10-3mol/L,则氢气的浓度增加5×10-3mol/L×3=0.015mol/L,v(H2) =0.015mol/L/5min= 0.003mol·L-1min-1;
②温度相同时,增大压强,平衡逆向移动,则甲烷的转化率减小,所以p1<p2;
③原料气中甲烷与二氧化碳体积分别是x、y,则(i)中产生CO的体积是x,氢气的体积是3x;二氧化碳与氢气的反应中消耗氢气的体积是y,生成CO的体积是y,所以最终氢气的体积是3x-y,CO的体积是x+y,二者恰好反应的体积比CO:H2=1:2=(x+y):(3x-y),解得x:y=3:1;
(2)①反应(ii)是熵减的反应,所以若反应自发进行,则一定有 <0,根据△G=△H-T△S<0反应自发,△S<0,则T应较小,所以该反应在低温下可能自发进行;
<0,根据△G=△H-T△S<0反应自发,△S<0,则T应较小,所以该反应在低温下可能自发进行;
②因为氧化亚铜与CO发生反应生成Cu和二氧化碳气体,所以体系内含有二氧化碳,平衡逆向移动,则不利于氧化亚铜被CO还原,从而维持Cu2O的量不变,化学方程式是Cu2O+CO 2Cu+CO2;
2Cu+CO2;
③原平衡是在恒容条件下,压强减小,所以保存压强不变时,则容器的体积减小,相当于在原平衡的基础上,增大压强,平衡正向移动,则甲醇的物质的量增大,但仍是小于1mol,同时压强增大,反应速率加快,达到平衡的时间缩短,则对应的图像为 ;
;
(3)①根据图可知,“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”三种压强下,3.5×106Pa时甲醇的转化率是30%,4.0×106Pa是甲醇的转化率是50%,而5.0×106Pa比4.0×106Pa增大了1.0×106Pa,但甲醇的转化率还增大不到5%,对设备的要求更高,但转化率增大的程度不大,所以最适宜的压强是4.0×106Pa;
②根据图27-3可知,温度低于80℃,反应速率较小;高于80℃时,曲线较平缓,说明温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,甲醇转化率降低,所以实际工业生产中采用的温度是80℃。
考点:考查对物质制备过程的分析,设计化学平衡,对图像的分析,反应条件的判断


科目:高中化学 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.明矾水解形成的Al(0H)3胶体能杀菌消毒,可用于水的净化
B.镀锡的铁制品比镀锌的铁制品耐用
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HC1和CH3COOH恰好中和时,消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:选择题
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
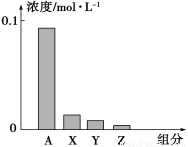
A.HA为强酸
B.图中X表示HA,Y表示OH-,Z表示H+
C.该混合液pH=7
D.该混合溶液中:c(A-)+c(HA)=c (Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关化学键与晶体说法中,不正确的是
A.离子晶体的晶格能越大,离子晶体的密度就越大
B.共价键的键能越大,分子晶体的熔、沸点越高
C.成键原子的原子轨道重叠越多,共价键越牢固
D.共用电子对不发生偏移的化学键是非极性共价键
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A.SiO2和SO2 B.NaCl和HCl
C.CO2和H2O D.CH4和KCl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:选择题
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
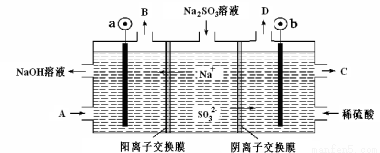
A.b电极上的主反应是 SO32--2e-+H2O===SO42-+2H+
B.若D是混合气体,则可能含有SO2、O2等成分
C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:推断题
(18分)Ⅰ.A、B、C、D、E、F是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
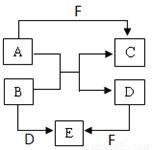
(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,F为强碱(部分产物略去)
则B+D→E的离子方程式为 ,C为同周期元素构成的1∶1型化合物,则C的电子式为 。
(2)若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为 ,A+B→C+D的化学方程式为 。
Ⅱ.甲、乙都是二元固体化合物,将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,经分析乙与红棕色固体的组成元素相同,向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g.
(1)写出构成甲的阴离子的结构示意图 ;32g甲在足量浓硝酸中反应转移的电子数为 ;甲在足量氧气中充分灼烧的化学方程式为 。
(2)乙的化学式 ;稀硫酸溶解乙的化学方程式为 。
(3)将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为 ,设计实验证明此步反应后的溶液中金属元素的化合价 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,常温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是

A.反应前气体的总体积为1.344L
B.装置中产生大量的白色烟雾
C.反应前后分子总数不变,均为0.06 NA个
D.生成物充分溶于水后所得溶液含有0.01 NA个NH4+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:选择题
化学家及其突出贡献为: ①波义耳(化学元素概念);②道尔顿(原子学说);③门捷列夫(元素周期律);④玻尔(玻尔原子模型)。这些突出贡献提出的年代顺序是
A.①②③④ B.②④①③ C.③①④② D.③④①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com