
| A. | 用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu═Fe2++Cu2+ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 用小苏打治疗胃酸过多:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量CO2:AlO${\;}_{2}^{-}$+CO2+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ |
分析 A.电荷不守恒;
B.一水合氨为弱碱应保留化学式;
C.小苏打为碳酸氢钠,碳酸氢根离子不能拆;
D.二者反应生成氢氧化铝和碳酸氢钠.
解答 解:A.用FeCl3溶液腐蚀印刷电路板上铜箔,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.AlCl3溶液中加入足量的氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.用小苏打治疗胃酸过多,离子方程式:HCO3-+2H+═CO2↑+H2O,故C错误;
D.偏铝酸钠溶液中通入过量CO2,离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2→HClO→NaClO | B. | Fe→Fe2O3→Fe(OH)3 | ||
| C. | S→SO3→H2SO4 | D. | NH3→NO2→HNO3→NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
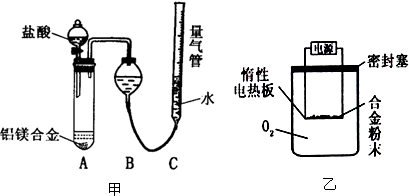
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有3种官能团 | |
| B. | 遇FeCl3溶液呈现为紫色 | |
| C. | 1mol该物质最多可与2molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中的钢闸门连接电源的负极 | B. | 地下钢管连接锌板 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 金属护拦表面涂漆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 紧闭门窗,防止装修面干裂或变质 | |
| B. | 适度开窗通风,充分进行室内外空气对流 | |
| C. | 请专业环境监测人员进行检测 | |
| D. | 在各个房间均匀地适量放置吊兰、芦荟等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
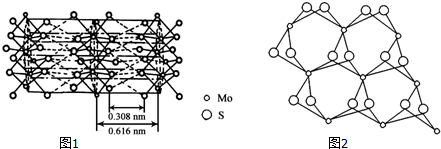
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com