
【题目】据报道科研人员应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②N—N键的键能为167 kJ·mol-1。请回答下列问题:
(1)N60分子组成的晶体为______晶体,其熔、沸点比N2______(填“高”或“低”),原因是________________________。
(2)1 mol N60分解成N2时吸收或放出的热量是________ kJ(已知![]() 键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种)________________________。
【答案】 分子 高 N60和N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高 13230 < N60可作高能炸药
【解析】(1)N60、N2均为分子晶体,组成和结构相似的分子晶体,相对分子质量越大的,分子间作用力大,其熔、沸点就越高;正确答案:分子;高; N60和N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高。
(2)每个氮原子均以N—N键结合三个N原子,每个N—N键被2个氮原子共用,每个氮原子有1.5个N—N键,1个N60分子结构中含有1.5×60=90个N—N键;根据反应:N60(s)==30N2(g)H;H=反应物断键吸收的总能量-生成物成键放出的总能量=167×90-30×942=-13230 kJ·mol-1;该反应放热,N60能量高不稳定,所以稳定性N60<N2;正确答案:13230; <。
(3) N60不稳定,变为氮气时,放出非常多的能量,可作高能炸药;正确答案:N60可作高能炸药。


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
【题目】据报道,某些花岗岩会产生氡(![]() Rn),对人体产生伤害。请回答:
Rn),对人体产生伤害。请回答:
(1)该原子的质量数是________,质子数是________,中子数是________。
(2)请根据Rn的原子结构预测,氡气的化学性质________。
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼
D.很难与其他物质发生反应
你选择该选项的理由是______________________________________________。
(3)研究发现,镭能蜕变为![]() Rn,故称
Rn,故称![]() Rn为镭射气;钍能蜕变为
Rn为镭射气;钍能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为钍射气;锕能蜕变为
Rn称为钍射气;锕能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为锕射气。则
Rn称为锕射气。则![]() Rn、
Rn、![]() Rn、
Rn、![]() Rn是________。
Rn是________。
A.同种元素 B.同位素
C.同种核素 D.同种原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
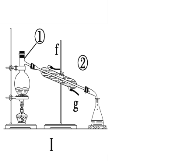
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向XmL0.01mol/L的氨水中滴加等物质的量浓度的H2SO4溶液,测得混合溶液的POH=—lgc(OH-)、温度随加入的硫酸溶液体积的变化如图所示。下列说法正确的是

A. X=20
B. b点时溶液的POH=PH
C. a,b,d三点NH3·H2O的电离常数: K(b)>K(d)>K(a)
D. c点对应的溶液中:C(SO42-)>C(NH4+)>C(H+)>C(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为CO2分子晶体结构的一部分,观察图形。试说明每个 CO2分子周围有________个与之紧邻且等距的 CO2分子;该结构单元平均占有________个CO2分子。

(2)在40 GPa高压下,用激光器加热到1800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是________。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4 mol C—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
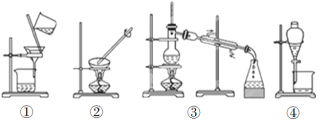
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量__________溶解,再向该溶液中加入适量的__________溶液,如有____________现象产生,则证明产物中存在Fe2O3
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为_______________(填装置序号)
②实验中如观察到装置A中品红溶液______,装置B BaCl2溶液中__________,则可证明FeSO4高温分解产生的气体中含有SO2、SO3。
③装置C中NaOH溶液的作用是_______________(用离子方程式表示〕。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com