
 ﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.
﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.| △n(Y) |
| △n(X) |
| 0.6-0.4 |
| 0.6-0.2 |


科目:高中化学 来源: 题型:
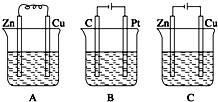 如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石溶于醋酸中的反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| D、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| B | D | C | B | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| n(B) |
| n(D) |
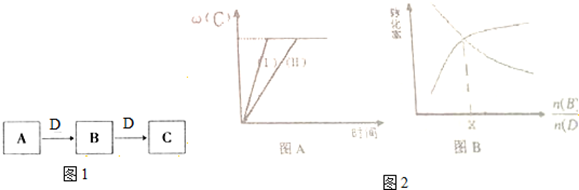
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.80 | 21.00 |
| 2 | 20.00 | 1.00 | 20.80 |
| 3 | 20.00 | 0.20 | 22.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 -CH=CH2)的叙述错误的是( )
-CH=CH2)的叙述错误的是( )| A、可以和溴水反应 |
| B、是苯的同系物 |
| C、分子中有4个碳碳双键 |
| D、1mol苯乙烯可以和4mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com