
| A. | 分子内化学键 | B. | 共价键键能 | C. | 分子的构型 | D. | 分子间作用力 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液显酸性是因为:HSO3-+H2O?SO32-+H3O+ | |
| B. | 尼泊金酸(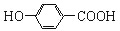 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: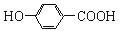 +2HCO3-→ +2HCO3-→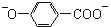 +CO2↑+2H2O +CO2↑+2H2O | |
| C. | KAl(SO4)2溶液中加入少量氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 足量硫酸氢钠溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
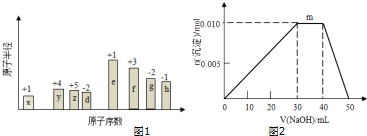
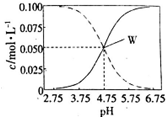 室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )
室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )| A. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| C. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)- | |
| D. | pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
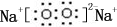 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.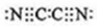 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
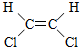 与
与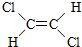 两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )| A. | 1,1-二氯乙烯 | B. | 丙烯 | C. | 2-丁烯 | D. | 1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
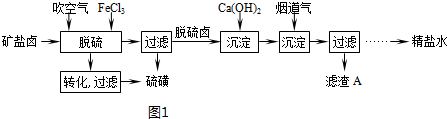
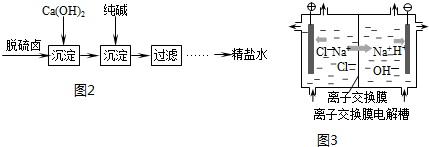
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:$\stackrel{18}{8}$O | |
| B. | 氧原子的结构示意图: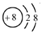 | |
| C. | 水分子的电子式: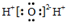 | |
| D. | 乙醛的结构简式:CH3COH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com