
 计算白磷的物质的量,白磷为正四面体结构,1mol白磷含有6molP-P键,据此计算P-P键的物质的量,再根据N=nNA计算P-P键数目;
计算白磷的物质的量,白磷为正四面体结构,1mol白磷含有6molP-P键,据此计算P-P键的物质的量,再根据N=nNA计算P-P键数目; 计算56gFe的物质的量,铁与硫反应生成硫化亚铁,再根据N=nNA计算转移电子数目;
计算56gFe的物质的量,铁与硫反应生成硫化亚铁,再根据N=nNA计算转移电子数目; 计算混合物的物质的量,1molNa2S、1molNa2O2都含有1mol阴离子,据此计算;
计算混合物的物质的量,1molNa2S、1molNa2O2都含有1mol阴离子,据此计算;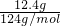 =0.1mol,白磷为正四面体结构,1mol白磷含有6molP-P键,故12.4g比例含有P-P键的物质的量0.6mol,P-P键数目为0.6mol×6.02×1023mol-1=0.6×6.02×1023,故②正确;
=0.1mol,白磷为正四面体结构,1mol白磷含有6molP-P键,故12.4g比例含有P-P键的物质的量0.6mol,P-P键数目为0.6mol×6.02×1023mol-1=0.6×6.02×1023,故②正确; =1mol,铁与硫反应生成硫化亚铁,铁完全反应,故转移电子数目为1mol×2×NAmol-1=2NA,故③错误;
=1mol,铁与硫反应生成硫化亚铁,铁完全反应,故转移电子数目为1mol×2×NAmol-1=2NA,故③错误;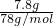 =0.1mol,1molNa2S、1molNa2O2都含有1mol阴离子,故7.8g Na2S和Na2O2的混合物中含有的阴离子数为0.1×6.02×1023,故⑥错误;
=0.1mol,1molNa2S、1molNa2O2都含有1mol阴离子,故7.8g Na2S和Na2O2的混合物中含有的阴离子数为0.1×6.02×1023,故⑥错误;

科目:高中化学 来源: 题型:
| A、4 g重水(D2O)中所含质子数为0.2×6.02×1023 | B、2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2×6.02×1023 | C、4.48 L H2和O2的混合气体中所含分子数为0.2×6.02×1023 | D、0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com