
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2012-2013学年天津市河北区高三年级总复习质量检测二理综化学试卷(解析版) 题型:实验题
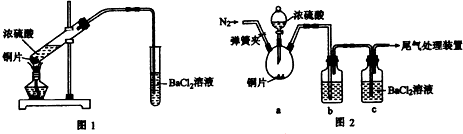
I、二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。

(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。
(2)一化学研究性学习小组设计用如下装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaC!:溶液,产生白色沉淀上述方案合理的是方案______(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子反应方程式为____________________。
③当通入二氧化硫至试管c中溶液显中性时,溶液中c(Na+)=________________(用含硫元素微粒浓度的代数式表示)。
Ⅱ、另一化学研究性学习小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:
电解时,粗铜应与电源的______极相连。阴极上的电极反应式为____________。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该反应的离子方程式:
____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com