
 2Fe2O3+8SO2
2Fe2O3+8SO2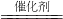 4NO+6H2O
4NO+6H2O 2Fe2O3+8SO2,在接触室中进行的反应为2SO2+O2
2Fe2O3+8SO2,在接触室中进行的反应为2SO2+O2  2SO3,工业上制硝酸是用氨的催化氧化法,氨被氧气催化氧化的化学反应方程式为4NH3+5O2
2SO3,工业上制硝酸是用氨的催化氧化法,氨被氧气催化氧化的化学反应方程式为4NH3+5O2 4NO+6H2O,工业制硫酸、硝酸,会生成二氧化硫、三氧化硫、一氧化氮、二氧化氮等酸性气体,而且这些气体都有毒,需对其进行尾气处理等来解题.
4NO+6H2O,工业制硫酸、硝酸,会生成二氧化硫、三氧化硫、一氧化氮、二氧化氮等酸性气体,而且这些气体都有毒,需对其进行尾气处理等来解题. 2Fe2O3+8SO2,在接触室中进行的反应为
2Fe2O3+8SO2,在接触室中进行的反应为 2SO3,A选项内容不正确,符合题意,故A正确;
2SO3,A选项内容不正确,符合题意,故A正确; 4NO+6H2O,B选项内容正确,故B错误;
4NO+6H2O,B选项内容正确,故B错误;

科目:高中化学 来源: 题型:阅读理解
 绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
A.在接触室中进行的反应为:4FeS2+11O2
| ||||
B.氨被氧气催化氧化:4NH3+5O2
| ||||
| C.硫酸工业、硝酸工业都需要对工业尾气进行处理 | ||||
| D.接触法制硫酸的原料为:二氧化硫、空气、水 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省济南市历下一中高一(上)期中化学试卷(解析版) 题型:选择题
 2Fe2O3+8SO2
2Fe2O3+8SO2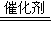 4NO+6H2O
4NO+6H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com